Учебные материалы
Объявления
Конектбиофарм
Работа
Компании
|
|||
|
|||
|
Остеосинтез полимерами
В настоящее время полимеры не могут конкурировать с металлическими фиксаторами для остеосинтеза. Однако исключительно быстрые темпы развития химии высокомолекулярных соединений за последние 50 лет, широкое варьирование их молекулярной массы и стереоструктуры, а также безграничные возможности самых разнообразных сочетаний полимеров определяют большой интерес ученых и клиницистов к изучению и внедрению в медицину этих перспективных материалов.
В травматологии и ортопедии известно использование полимеров для остеосинтеза в трех основных направлениях: полимерные фиксаторы как заменители металлических; химический остеосинтез полимерами; адгезивный ультразвуковой остеосинтез полимерами.
Хотя остеосинтез полимерами далек от совершенства и имеет весьма ограниченные показания для клинического применения, перспективность развития этой проблемы несомненна и травматологи-ортопеды вправе ожидать, что в ближайшее время достижения химии высокомолекулярных соединений позволят получить синтетические материалы, отвечающие требованиям современного остеосинтеза, ибо возможности химии полимеров медицинского назначения поистине неисчерпаемы [Мовшович И. А., Виленский Б. Я., 1978; Манабу Саноо, 1981].
Современная травматология и ортопедия располагают богатым арсеналом разнообразных внутренних фиксаторов отломков костей. Однако это в основном металлические конструкции из нержавеющей стали, титана или других биоинертных сплавов, нерассасывающихся и требующих, как правило, последующего извлечения из организма пациента.
Повторные оперативные вмешательства, направленные на удаление выполнивших свою роль металлических фиксаторов, нередко являются значительно более травматичными, чем сам остеосинтез, могут сопровождаться осложнениями и влекут за собой увеличение сроков стационарного лечения, нетрудоспособности и реабилитации больных. Поэтому заманчивая способность полимеров рассасываться привлекает особое внимание к их применению для остеосинтеза.
Требования к остеосинтезу полимерами.
Остеосинтез полимерами должен удовлетворять всем основным требованиям, предъявляемым вообще к любому виду остеосинтеза. Кроме того, определены допустимые характеристики, которым должны соответствовать полимерные имплантаты. Это, прежде всего, достаточная для фиксации отломков костей прочность полимеров и относительная стабильность их физико-механических параметров до завершения процессов консолидации переломов. Во-вторых, необходима биологическая совместимость полимеров с окружающими тканями организма и биологическая инертность при их внутритканевой имплантации. Третьим важным требованием является способность полимерных фиксаторов постепенно рассасываться и замещаться структурно и функционально полноценными биологическими тканями. При этом низкомолекулярные продукты биодеструкции и биодеградации в процессе старения полимеров не должны обладать общими или местными токсическими, аллергическими или канцерогенными свойствами.
Использование полимерных фиксаторов при остеосинтезе вполне допустимо, если они или их компоненты при рассасывании не замедляют процессы репаративной регенерации костной ткани.
Полимерные фиксаторы должны также быть технологичными, т. е. простыми и доступными в изготовлении, при стерилизации и применении при остеосинтезе.
Желательно, чтобы полимерные материалы для остеосинтеза обладали бактерицидными свойствами и содержали вещества, стимулирующие остеорепарацию.
Полимерные фиксаторы.
В качестве фиксаторов как заменителей металла наибольшее распространение получили конструкционный термопласт полиамид-12 (П-12), специальные лавсановые ленты и рассасывающиеся штифты на основе сополимера 1М-винилпирролидона и метилметакрилата [Волков М. В., Любошиц Н. А., 1979].
Полиамид-12 характеризуется следующими физико-механическими свойствами: плотность — 1,02 г/см3; температура плавления — 178 °С. Водостойкость, высокая стабильность и прочность свойственны этому материалу. Его показатели в воде: водопоглощение при 20 °С— 1,5; предел текучести — 450 кгс/см2; предел прочности при растяжении — 550 кгс/см2; относительное удлинение — 230 %, предел прочности при изгибе — 680 кгс/см2; удельная ударная вязкость — 20 кгс/см2 и коэффициент трения — 0,12.
Полиамид-12 перерабатывается литьем под давлением и экструзией, что позволяет изготавливать из него различные фиксаторы для остеосинтеза: винты, болты, гвозди, балки и комбинированные металлполимерные конструкции.
Экспериментально и клинически доказана возможность использования фиксаторов из полиамида-12 при косых, косопоперечных и винтообразных переломах длинных трубчатых костей. Упругость полимерных фиксаторов из полиамида-12 обеспечивает успешное их применение при остеосинтезе в метафизарных отделах, особенно при переломах хирургической шейки плечевой кости.
Известно использование для остеосинтеза специальных лент из полиэтилентерефталата (ПЭТФ, лавсан). Синтезированное в лаборатории высокомолекулярных соединений АН СССР лавсановое волокно получило широкое распространение в пластической хирургии. Для травматологии и ортопедии разработаны и выпускаются отечественной промышленностью тканные мелкоячеистые лавсановые ленты ЦИТО и плетенотканные крупноячеистые лавсановые ленты «ЦИТО-Север». Физико-механические свойства лавсановых лент обеспечивают их относительную стабильность в биологических средах, биоинертность, биосовместимость и возможность их стерилизации. В костной ткани лавсановые ленты частично прорастают фиброзной соединительной тканью. Возможно использование лавсановых лент для серкляжного шва при кососпиральных переломах длинных трубчатых костей и для лавсанодеза костных фрагментов при остеотомии, например при операции Мак-Марри. При этом следует принимать во внимание, что в 1-й месяц после остеосинтеза удлинение лавсановой ленты может существенно снижать прочность фиксации отломков костей, а наличие серкляжного шва из стабильной лавсановой ленты чревато дистрофическими расстройствами в кортикальной пластинке длинной трубчатой кости, уменьшением ее механической прочности, патологическими переломами.
Учитывая растяжимость лавсановых лент, их применение при остеосинтезе требует оснащения специальным инструментарием, обеспечивающим достаточное натяжение при завязывании узлов, прошивании или сваривании концов ленты.
Во Всесоюзном научно-исследовательском испытательном институте медицинской техники (ВНИИИМТ) Минздрава СССР разработаны рассасывающиеся полимерные штифты на основе сополимера винилпирролидона и метилметакрилата, армированного полиамидным волокном. В модельных средах и при имплантации в биологические ткани они набухают, затем подвергаются биодеградации. По данным гравиметрии, максимальный градиент изменения массы рассасывающихся штифтов наблюдается в первые 3 — 10 сут с последующей стабилизацией скорости деструкции. Продукты биодеградации не оказывают выраженного общего или местного токсического воздействия на организм больного.
Различные модификации рассасывающихся штифтов (рентгеноконтрастные, с антисептиком или биостимуляторами, с электропроводным покрытием) успешно применялись при интрамедуллярном остеосинтезе бедренной и большеберцовой костей, костей предплечья, ключицы, мелких трубчатых костей кисти и стопы, при переломах в области голеностопного сустава.
В зависимости от размеров и особенностей наружного покрытия рассасывание штифтов происходит от 4 мес до 2 лет с постепенным замещением фиброзно-костной тканью, среди которой длительно сохраняются фрагменты армировавших штифты полиамидных волокон. Замедление процессов репаративной регенерации костной ткани при остеосинтезе рассасывающимися штифтами не установлено.
Доказано, что при остеосинтезе полимерными рассасывающимися штифтами с антисептическим покрытием диоксидином частота гнойных осложнений в инфицированных ранах снижается почти в 2 раза. Это подтверждается клиническими наблюдениями использования рассасывающихся штифтов для остеосинтеза при обширных дефектах после открытых осложненных переломов длинных трубчатых костей.
К положительным качествам полимерных штифтов можно отнести их способность рассасываться и замещаться в биологических тканях, пластичность материала, позволяющая моделировать фиксаторы во время операции, доступность и сравнительная технологичность производства. В то же время большая деформация и текучесть существенно затрудняют интрамедуллярное введение рассасывающихся штифтов, требуют использования специальных направителей-набойников. При вынужденном удалении рассасывающихся штифтов из канала трубчатой кости встречаются серьезные технические трудности.
Химический остеосинтез полимерами.
Идея соединять отломки костей при переломах с помощью склеивающих веществ имеет большую историю, сведения об эмпирических попытках претворить ее в практику содержатся в древних рукописях. Но первое научное сообщение об успешном клиническом применении стерильного рассасывающегося клея «Осакол» относится к 1931 г. и связано с именем Hedri. В 1936 г. Г. Л. Шапиро представил данные о благоприятных результатах использования неолейкорита при лечении больных. Однако только с 1956 г., после опубликования работы проф. Г. В. Головина «О возможности склеивания костей при переломах», началось всестороннее изучение проблемы склеивания биологических тканей. Заслуга развития химического остеосинтеза (склеивания костей) принадлежит советским ученым.
С достижениями химии полимеров изменились и используемые в костной хирургии синтетические препараты. На смену механическому остеосинтезу полимерами появился адгезивный остеосинтез акриловыми производными, эпоксидными и полиуретановыми смолами и, наконец, цианоакрилатными композициями.
Первыми, как у нас в стране, так и за рубежом, для полимерного остеосинтеза начали использовать быстротвердеющие препараты на основе метилметакрилата (стиракрил, осакрил, палапоит, палавит, палакос и др.). С 1956 г. в СССР проводились широкие испытания отечественного эпоксидного препарата «Остеопласт», а двумя годами позже за рубежом появились первые сообщения о применении при операциях на костях препарата на основе полиуретана «Остамер» и эпоксидного клея «Агаldite АW-120». Однако уже в 60-х годах цианоакрилатные соединения (циакрин, М-2-Ц, истмэн-910, кодак, биобонд, Аpon-аlpha-А «Санкио» и др.), выгодно отличающиеся физико-химическими и биологическими свойствами, вытесняют своих предшественников.
Создание советскими учеными новых способов ускорения полимеризации с помощью ультразвука в значительной мере способствовало расширению возможностей применения цианоакрилатных композиций в костной хирургии.
Первая в мире научная работа «Остеосинтез и заполнение дефектов костей с помощью ультразвуковой сварки» была опубликована В. А. Поляковым в 1969 г., а в 1972 г. за разработку и применение в клинической практике методов ультразвукового соединения костей после переломов, ортопедических и торакальных операций, воссоздание костной ткани при заболеваниях и дефектах костей, а также ультразвуковой резки живых биологических тканей творческий коллектив в составе акад. АМН СССР М. В. Волкова, чл.-кор. АН СССР Г. А. Николаева, профессоров В. А. Полякова и В. И. Петрова, доцентов Г. Г. Чемянова и В. И. Лощилова был удостоен Государственной премии СССР.
Рассматривая проблему химического остеосинтеза, необходимо учитывать особенности протекания реакции полимеризации склеивающих препаратов (экзотермичность, скорость), прочность адгезии и когезии, их работоспособность во влажной среде.
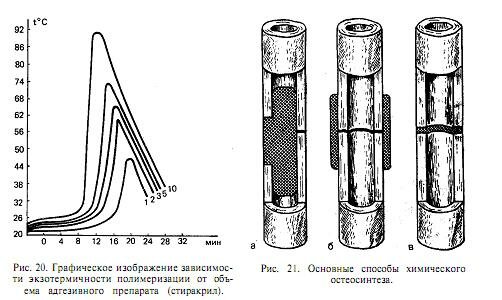
Отвердение акрилатов, эпоксидных и полиуретановых препаратов сопровождается ярко выраженной экзотермической реакцией, существеннозависимой от соотношения компонентов, количества отвердителя или катализатора, от массы полимеризуемого препарата (рис. 20). При этом температура полимеризации превышает порог коагуляции белков, что сопровождается ожогами и некрозом окружающих полимер тканей.
Микробиологическими исследованиями установлены микробная загрязненность, преимущественно кокковой флорой, большинства порошкообразных полимеров и смол адгезивных препаратов и стерильность их мономеров и отвердителей.
В посевах со свежеприготовленных акрилатов, эпоксидов и полиуретанов определяется рост микробных колоний. Цианоакрилаты отличаются выраженными бактериостатическими и бактерицидными свойствами. Поэтому при использовании быстротвердеющих акрилатов, эпоксидных и полиуретановых препаратов для химического остеосинтеза необходима их тщательная стерилизация, а применение цианоакрилатов возможно без дополнительной их обработки.
Выделяют три основных способа химического остеосинтеза: интрамедуллярный (рис. 21, а), экстракортикальный (рис. 21,6) и интерпозиционный (рис. 21, в). Биомеханические параметры подтверждают возможность создания достаточно прочного соединения костных отломков при интрамедуллярном остеосинтезе акрилатами, эпоксидами и полиуретанами и при интерпозиционном остеосинтезе — цианоакрилатами. Однако заполнение мозговой полости длинных трубчатых костей жидким адгезивом является травматичным вмешательством. Совершенно необходимое высушивание и обезжиривание при подготовке костного ложа, адгезивная интимная связь препарата с ним на большом протяжении со стороны эндоста, экзотермичность полимеризации — все это неблагоприятно влияет на остеорепарацию. Кортикальная пластинка после интрамедуллярного химического остеосинтеза акрилатами, эпоксидами или полиуретанами, как правило, секвестрируется (рис. 22).
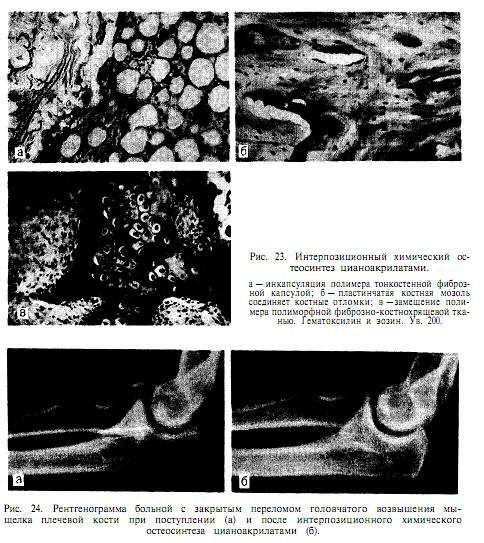
При экстракортикальном и интерпозиционном остеосинтезе отвердевший полимер является интерпозитом, препятствующим врастанию соединительной ткани и формированию костной мозоли. Только композиции на основе цианоакрилатов обладают бактерицидными свойствами при биодеструкции в тканях, способны рассасываться и замещаться костной тканью (рис. 23).
В настоящее время для химического остеосинтеза могут быть рекомендованы только цианоакрилатные композиции (МК-7, МК-9). Их использование может быть успешным при остеосинтезе мелких трубчатых костей, для фиксации ненагрузочных костных фрагментов, особенно при внутрисуставных переломах (рис. 24). Но при этом прочность фиксации весьма незначительна и наибольших своих значений достигает в течение 24-48 ч.
Адгезивный ультразвуковой остеосинтез.
Известны адсорбционно-молекулярная, электрическая, диффузионная и комбинированная теории адгезии полимеров. Механизмы адгезивного соединения чрезвычайно сложны и зависят от многих факторов: свойств адгезива, особенностей склеиваемых поверхностей, характера границы раздела «адгезив-субстрат».
Воздействуя химическими или физическими агентами (катализаторами, ингибиторами, теплом, давлением, током высокой частоты, оптическими квантовыми генераторами, ультразвуком и др.), возможно управление различными механизмами полимеризации мономеров. Весьма перспективным оказалось использование для этих целей ультразвука, механическое, физико-химическое и тепловое действие которого известны и широко используются в физиотерапии. Описаны обезболивающий, метаболический, антимикробный, стимулирующий остеорепарацию и другие положительные эффекты воздействия ультразвука на биологические ткани.
Новый метод адгезивного ультразвукового остеосинтеза начали разрабатывать в 1964 г. на кафедре травматологии ЦОЛИУВ В. А. Поляков и Г. Г. Чемянов и в МВТУ имени Н. Э. Баумана Г. А. Николаев и В. И. Лощилов. В 1967 и 1970 гг. Комитет по делам изобретений и открытий выдал авторские свидетельства СССР № 263074 и 312601 за разработку нового способа фиксации костей, названного авторами ультразвуковой сваркой, а Министерство здравоохранения СССР разрешило его использование в клинической практике.
Сущность ультразвуковой сварки костей (ультразвукового адгезивного остеосинтеза) заключается в том, что электрические колебания, вырабатываемые генератором, подают на обмотку магнитостриктора, который преобразует их в механические. Механические колебания трансформируются с помощью волновода-концентратора и передаются на смесь адгезивного цианоакрилатного мономера с наполнителем, помещенную в область перелома.
Под действием механических колебаний ускоряется полимеризация мономера и формируется полимерный конгломерат, соединяющий костные фрагменты. Целесообразно использование ультразвуковых установок типа УРСК-7Н или УЗГ-2-04 с рабочим диапазоном частот от 20 до 50 кГц и амплитудой механических колебаний торца волновода-концентратора 40—60 мкм. Введение энергии с помощью ультразвука в жидкий адгезивный мономер создает явления локальной кавитации, возникают акустические потоки, переменные колебательные ускорения и знакопеременные давления. Исследованиями с помощью электронного парамагнитного резонанса доказано, что при этом разрываются связи в мономере и образуются свободные радикалы, происходит перемешивание мономера, интенсификация процессов конвективной диффузии активных радикалов адгезива и тем самым ускоряется полимеризация цианоакрилатной композиции.
Под воздействием ультразвука повышается средняя глубина проникновения мономера в костную ткань, которая может достигать 150—200 мкм. При интенсивности ультразвука в зоне контакта с костью около 0,8—1 Вт/см2 температура в полимеризующемся конгломерате не превышает 50-70°С.
В качестве наполнителей возможно использование гранул или волокон аллогенной костной стружки, микрокапсулированных солей кальция и др.
Ускоренная полимеризация с помощью ультразвука при адгезивном остеосинтезе может обеспечивать быструю и достаточно прочную фиксацию костных отломков или осколков на операционном столе и снижение экспозиции относительно токсичного мономера-адгезива на раневые поверхности.
Адгезивный ультразвуковой остеосинтез сопровождается заполнением полостей, пор и каналов соединяемых костных поверхностей биополимерным конгломератом и формированием достаточно прочных механических и химических связей. Всякое действие характеризуется противодействием, и повышение прочности соединения неизбежно связано с изменением давления в пограничной с полимером зоне. Судьба биологических клеток и тканей, длительно находящихся под воздействием механического давления на большом протяжении контакта с полимером, известна — наступают необратимые трофические расстройства и они погибают. Следовательно, допустимым является адгезивное соединение с биологически целесообразной прочностью. Чем на большей поверхности выполняется адгезивный ультразвуковой остеосинтез, тем выше первоначальная прочность соединения, но и в большей степени выражены и раньше начинаются процессы отторжения, снижается прочность биополимерного конгломерата в живых тканях.
В сроки от 1 нед до 1,5 мес биополимерный конгломерат набухает, фрагментируется и отслаивается от материнского костного ложа (рис. 25), инкапсулируется фиброзной тканью. Его полное рассасывание и замещение протекают многие месяцы.
Остеогенетическая функция лиофилизированной аллогенной костной стружки при адгезивном ультразвуковом остеосинтезе не наблюдается.
Окруженные массами полимера ее фрагменты подвергаются некробиотическим изменениям, некротизируются и со временем постепенно резорбируются. Избыточная интерпозиция биополимерного конгломерата между раневыми поверхностями кости препятствует остеорепарации, в этих случаях наблюдается замедленная консолидация или формирование ложных суставов.
Воздействие механических колебаний непосредственно на костные отломки при адгезивном ультразвуковом остеосинтезе, по данным растровой электронной микроскопии, сопровождается локальным повреждением сосудисто-нервных окончаний в надкостнице, что клинически проявляется обезболивающим эффектом в ранние сроки после операции. Эти сенситивные изменения носят временный обратимый характер, и через несколько суток болевая чувствительность восстанавливается.
Результаты биомеханических исследований не позволяют рассчитывать на длительное сохранение прочности в процессе рассасывания и перестройки биополимерного конгломерата, первоначальная прочность которого не компенсируется за счет фиброзных волокон, прорастающих в полимер значительно позже его фрагментации. Следовательно, для активации репаративной регенерации костной ткани и сращения отломков костей их соединение должно быть выполнено на небольшом протяжении, а раневые поверхности костных фрагментов на большей части не разъединены массами биополимерного конгломерата.
Учитывая перечисленные факторы, правомочно выделить принципиально важные условия, соблюдение которых позволяет обеспечить реализацию основных требований оперативного соединения костных фрагментов при адгезивном ультразвуковом остеосинтезе. В первую очередь к ним следует отнести следующие:
1. Относительно небольшие нагрузки или смещающие усилия на область соединения отломков или осколков кости. Попытки адгезивного ультразвукового остеосинтеза длинных трубчатых костей в диафизарном отделе не оправданы и, как правило, обречены на неудачу.
2. Создание надежного контакта раневых поверхностей кости на большом протяжении при минимальной площади адгезивного ультразвукового соединения. Интерпозиция биополимерного конгломерата является препятствием для процессов репаративной регенерации и замедляет консолидацию отломков костей. Гидролиз и резорбция избыточных количеств биополимера в биологических тканях сопровождаются проявлениями местных токсических свойств цианоакрилатных композиций.
3. Обязательное сочетание адгезивного ультразвукового остеосинтеза с надежной внешней иммобилизацией на протяжении средних сроков сращения переломов. Исключение могут составлять случаи фиксации небольших костных фрагментов неопорных отделов кости при отсутствии смещающих нагрузок.
4. Обоснованное и целесообразное сочетание и комбинирование способов адгезивного ультразвукового остеосинтеза с известными оперативными способами фиксации костных отломков.
Основные показания для адгезивного ультразвукового остеосинтеза:
оперативное лечение оскольчатых внутрисуставных переломов, фиксация небольших костных трансплантатов при костной пластике, фиксация мелких и средних осколков к материнскому костному ложу в сочетании с основными видами остеосинтеза при многооскольчатых переломах, создание неподвижности и дополнительная фиксация при комбинированном остеосинтезе, временное замещение костных полостей.
Безусловно, что адгезивный ультразвуковой остеосинтез во всех случаях показан только тогда, когда применение уже испытанных и зарекомендовавших себя оперативных методов затруднено, невозможно или малоэффективно.
Методика адгезивного ультразвукового остеосинтеза.
После открытой репозиции костные фрагменты адаптируют и удерживают с помощью однозубых крючков, спиц или шила. На поверхности кости в кортикальной пластинке через линию перелома ультразвуковой пилой или долотом готовят 2 — 3 паза, в зависимости от протяженности и формы линии излома, на глубину 2 — 4 мм размерами от 10 х 2 до 20 х 6 мм. Гемостаз, высушивание и обезжиривание соединяемых костных поверхностей достигают наложением жгута и использованием марлевых тампонов со спиртом и эфиром.
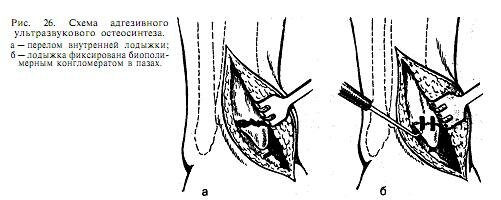
После тщательной подготовки стенки костного ложа смачивают несколькими каплями мономера-адгезива, затем пазы заполняют смесью лиофилизированной аллогенной костной стружки с цианокрилатным мономером в соотношении 1:1 и, создавая контакт рабочей поверхности волновода-концентратора со смесью, последнюю «озвучивают» до образования твердого конгломерата. В результате этого мостик из отвердевшего биополимерного конгломерата достаточно прочно, не образуя большой интерпозиции между раневыми поверхностями, фиксируют костные фрагменты (рис. 26).
Результаты.
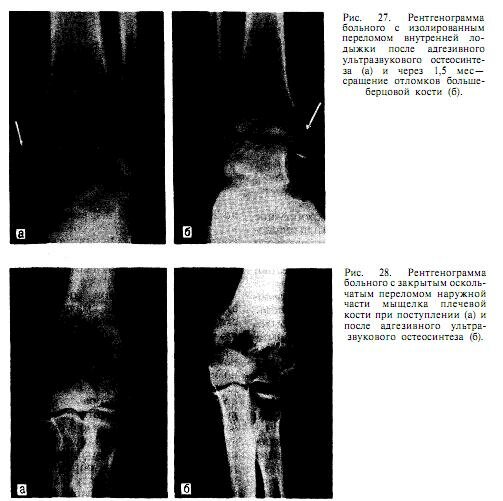
Использование адгезивного ультразвукового остеосинтеза по строгим показаниям позволяет получить хорошие анатомо-функциональные результаты (рис. 27, 28), особенно при оскольчатых внутрисуставных переломах. Его применение как самостоятельного метода фиксации костных фрагментов обеспечивает восстановление конгруэнтности суставных поверхностей, необходимую прочность в сочетании с внешней иммобилизацией для удержания костных осколков и тем самым способствует их консолидации в оптимальные сроки и ранней реабилитации больных. Отсутствует необходимость во 2-й операции — удалении металлических фиксаторов, сокращается срок стационарного лечения.
Комбинированный адгезивный ультразвуковой остеосинтез, когда отломки кости фиксируют металлическими конструкциями, а осколки — биополимерным конгломератом, значительно расширяет возможности и эффективность основных методов остеосинтеза, способствует их обездвиживанию и благоприятному течению репаративной регенерации, улучшает результаты оперативных вмешательств.
Сочетание адгезивного ультразвукового остеосинтеза одних из элементов многокомпонентных переломов, например в области локтевого, голеностопного или коленного суставов, с металлоостеосинтезом других костных отломков оправдано только при оскольчатых переломах, когда применение традиционных способов не представляется возможным.
Ошибки и осложнения.
Ошибки при адгезивном ультразвуковом остеосинтезе можно условно разделить на 3 основные группы: связанные с нарушением технологических процессов, техники оперативного вмешательства и медико-биологические ошибки.
Строгое соблюдение технологических процессов гарантирует прочность соединения костных фрагментов. При стабильной работе ультразвукового оборудования в оптимальном режиме первостепенное значение имеют: качество подготовки соединяемых поверхностей, соотношение и качество адгезива-мономера и костной стружки, длительность и характер «озвучивания», способ передачи энергии ультразвука и неподвижность соединяемых фрагментов до полной полимеризации.
Избыточное содержание в смеси мономера-адгезива повышает продолжительность полимеризации, а недостаточное смачивание наполнителя препятствует равномерной передаче ультразвуковых колебаний в толщу полимеризующегося конгломерата.
При недостаточной экспозиции «озвучивания» полимеризация происходит лишь на поверхности конгломерата. Излишне длительное воздействие сопровождается разогреванием рабочей части волновода-концентратора, вторичным размягчением первоначально отвердевшего конгломерата и повышением его липкости к операционным инструментам. В этом случае соединение получается непрочным и биополимерный конгломерат обугливается. Разница в экспозиции между этими нарушениями технологических параметров составляет от нескольких секунд до минуты в зависимости от общего объема полимеризуемой массы, контактного давления, геометрии и режима работы волновода-концентратора.
Большое значение имеет способ передачи энергии ультразвуковых колебаний. При длительном контакте волновода-концентратора в области перелома с пластинчатой костной тканью связь частично отвердевшего биополимерного конгломерата с костным ложем нарушается.
Ошибки оперативной техники заключаются в нецелесообразной последовательности этапов хирургического вмешательства при адгезивном ультразвуковом остеосинтезе, сочетающемся с остеосинтезом других элементов многокомпонентного перелома металлическими фиксаторами.
Нежелательные последствия медико-биологических ошибок связаны с недооценкой биологических особенностей репаративной регенерации при адгезивном ультразвуковом остеосинтезе. Наиболее типичные ошибки этой группы: распространение мономера-адгезива между раневыми поверхностями кости на большом протяжении с образованием биополимерного интерпозита; создание избыточных по массе и необоснованных по характеристикам прочности биополимерных конгломератов; попадание мономера, костной стружки или их смеси в окружающие мягкие ткани или в полость сустава; недостаточная внешняя иммобилизация и ранние нагрузки в послеоперационном периоде.
Среди возможных осложнений при адгезивном ультразвуковом остеосинтезе необходимо отметить местные воспалительные реакции в области биополимерного конгломерата, индивидуальную непереносимость у некоторых пациентов, асептическое воспаление и отторжение фрагментирующегося биополимерного конгломерата, нагноение операционной раны при нарушениях общих принципов асептики в хирургии. Общее количество осложнений не превышает 0,5-1,7%.
В настоящее время метод адгезивного ультразвукового остеосинтеза является достаточно сложным, и успешное его применение в высокоспециализированных травматолого-ортопедических учреждениях страны требует специальной подготовки и навыков от хирурга. В итоге, необходимо еще раз подчеркнуть, что по характеристикам прочности остеосинтез полимерами является репозиционным и требует искусного владения средствами иммобилизации.
С.С. Ткаченко
В травматологии и ортопедии известно использование полимеров для остеосинтеза в трех основных направлениях: полимерные фиксаторы как заменители металлических; химический остеосинтез полимерами; адгезивный ультразвуковой остеосинтез полимерами.
Хотя остеосинтез полимерами далек от совершенства и имеет весьма ограниченные показания для клинического применения, перспективность развития этой проблемы несомненна и травматологи-ортопеды вправе ожидать, что в ближайшее время достижения химии высокомолекулярных соединений позволят получить синтетические материалы, отвечающие требованиям современного остеосинтеза, ибо возможности химии полимеров медицинского назначения поистине неисчерпаемы [Мовшович И. А., Виленский Б. Я., 1978; Манабу Саноо, 1981].
Современная травматология и ортопедия располагают богатым арсеналом разнообразных внутренних фиксаторов отломков костей. Однако это в основном металлические конструкции из нержавеющей стали, титана или других биоинертных сплавов, нерассасывающихся и требующих, как правило, последующего извлечения из организма пациента.
Повторные оперативные вмешательства, направленные на удаление выполнивших свою роль металлических фиксаторов, нередко являются значительно более травматичными, чем сам остеосинтез, могут сопровождаться осложнениями и влекут за собой увеличение сроков стационарного лечения, нетрудоспособности и реабилитации больных. Поэтому заманчивая способность полимеров рассасываться привлекает особое внимание к их применению для остеосинтеза.
Требования к остеосинтезу полимерами.
Остеосинтез полимерами должен удовлетворять всем основным требованиям, предъявляемым вообще к любому виду остеосинтеза. Кроме того, определены допустимые характеристики, которым должны соответствовать полимерные имплантаты. Это, прежде всего, достаточная для фиксации отломков костей прочность полимеров и относительная стабильность их физико-механических параметров до завершения процессов консолидации переломов. Во-вторых, необходима биологическая совместимость полимеров с окружающими тканями организма и биологическая инертность при их внутритканевой имплантации. Третьим важным требованием является способность полимерных фиксаторов постепенно рассасываться и замещаться структурно и функционально полноценными биологическими тканями. При этом низкомолекулярные продукты биодеструкции и биодеградации в процессе старения полимеров не должны обладать общими или местными токсическими, аллергическими или канцерогенными свойствами.
Использование полимерных фиксаторов при остеосинтезе вполне допустимо, если они или их компоненты при рассасывании не замедляют процессы репаративной регенерации костной ткани.
Полимерные фиксаторы должны также быть технологичными, т. е. простыми и доступными в изготовлении, при стерилизации и применении при остеосинтезе.
Желательно, чтобы полимерные материалы для остеосинтеза обладали бактерицидными свойствами и содержали вещества, стимулирующие остеорепарацию.
Полимерные фиксаторы.
В качестве фиксаторов как заменителей металла наибольшее распространение получили конструкционный термопласт полиамид-12 (П-12), специальные лавсановые ленты и рассасывающиеся штифты на основе сополимера 1М-винилпирролидона и метилметакрилата [Волков М. В., Любошиц Н. А., 1979].
Полиамид-12 характеризуется следующими физико-механическими свойствами: плотность — 1,02 г/см3; температура плавления — 178 °С. Водостойкость, высокая стабильность и прочность свойственны этому материалу. Его показатели в воде: водопоглощение при 20 °С— 1,5; предел текучести — 450 кгс/см2; предел прочности при растяжении — 550 кгс/см2; относительное удлинение — 230 %, предел прочности при изгибе — 680 кгс/см2; удельная ударная вязкость — 20 кгс/см2 и коэффициент трения — 0,12.
Полиамид-12 перерабатывается литьем под давлением и экструзией, что позволяет изготавливать из него различные фиксаторы для остеосинтеза: винты, болты, гвозди, балки и комбинированные металлполимерные конструкции.
Экспериментально и клинически доказана возможность использования фиксаторов из полиамида-12 при косых, косопоперечных и винтообразных переломах длинных трубчатых костей. Упругость полимерных фиксаторов из полиамида-12 обеспечивает успешное их применение при остеосинтезе в метафизарных отделах, особенно при переломах хирургической шейки плечевой кости.
Известно использование для остеосинтеза специальных лент из полиэтилентерефталата (ПЭТФ, лавсан). Синтезированное в лаборатории высокомолекулярных соединений АН СССР лавсановое волокно получило широкое распространение в пластической хирургии. Для травматологии и ортопедии разработаны и выпускаются отечественной промышленностью тканные мелкоячеистые лавсановые ленты ЦИТО и плетенотканные крупноячеистые лавсановые ленты «ЦИТО-Север». Физико-механические свойства лавсановых лент обеспечивают их относительную стабильность в биологических средах, биоинертность, биосовместимость и возможность их стерилизации. В костной ткани лавсановые ленты частично прорастают фиброзной соединительной тканью. Возможно использование лавсановых лент для серкляжного шва при кососпиральных переломах длинных трубчатых костей и для лавсанодеза костных фрагментов при остеотомии, например при операции Мак-Марри. При этом следует принимать во внимание, что в 1-й месяц после остеосинтеза удлинение лавсановой ленты может существенно снижать прочность фиксации отломков костей, а наличие серкляжного шва из стабильной лавсановой ленты чревато дистрофическими расстройствами в кортикальной пластинке длинной трубчатой кости, уменьшением ее механической прочности, патологическими переломами.
Учитывая растяжимость лавсановых лент, их применение при остеосинтезе требует оснащения специальным инструментарием, обеспечивающим достаточное натяжение при завязывании узлов, прошивании или сваривании концов ленты.
Во Всесоюзном научно-исследовательском испытательном институте медицинской техники (ВНИИИМТ) Минздрава СССР разработаны рассасывающиеся полимерные штифты на основе сополимера винилпирролидона и метилметакрилата, армированного полиамидным волокном. В модельных средах и при имплантации в биологические ткани они набухают, затем подвергаются биодеградации. По данным гравиметрии, максимальный градиент изменения массы рассасывающихся штифтов наблюдается в первые 3 — 10 сут с последующей стабилизацией скорости деструкции. Продукты биодеградации не оказывают выраженного общего или местного токсического воздействия на организм больного.
Различные модификации рассасывающихся штифтов (рентгеноконтрастные, с антисептиком или биостимуляторами, с электропроводным покрытием) успешно применялись при интрамедуллярном остеосинтезе бедренной и большеберцовой костей, костей предплечья, ключицы, мелких трубчатых костей кисти и стопы, при переломах в области голеностопного сустава.
В зависимости от размеров и особенностей наружного покрытия рассасывание штифтов происходит от 4 мес до 2 лет с постепенным замещением фиброзно-костной тканью, среди которой длительно сохраняются фрагменты армировавших штифты полиамидных волокон. Замедление процессов репаративной регенерации костной ткани при остеосинтезе рассасывающимися штифтами не установлено.
Доказано, что при остеосинтезе полимерными рассасывающимися штифтами с антисептическим покрытием диоксидином частота гнойных осложнений в инфицированных ранах снижается почти в 2 раза. Это подтверждается клиническими наблюдениями использования рассасывающихся штифтов для остеосинтеза при обширных дефектах после открытых осложненных переломов длинных трубчатых костей.
К положительным качествам полимерных штифтов можно отнести их способность рассасываться и замещаться в биологических тканях, пластичность материала, позволяющая моделировать фиксаторы во время операции, доступность и сравнительная технологичность производства. В то же время большая деформация и текучесть существенно затрудняют интрамедуллярное введение рассасывающихся штифтов, требуют использования специальных направителей-набойников. При вынужденном удалении рассасывающихся штифтов из канала трубчатой кости встречаются серьезные технические трудности.
Химический остеосинтез полимерами.
Идея соединять отломки костей при переломах с помощью склеивающих веществ имеет большую историю, сведения об эмпирических попытках претворить ее в практику содержатся в древних рукописях. Но первое научное сообщение об успешном клиническом применении стерильного рассасывающегося клея «Осакол» относится к 1931 г. и связано с именем Hedri. В 1936 г. Г. Л. Шапиро представил данные о благоприятных результатах использования неолейкорита при лечении больных. Однако только с 1956 г., после опубликования работы проф. Г. В. Головина «О возможности склеивания костей при переломах», началось всестороннее изучение проблемы склеивания биологических тканей. Заслуга развития химического остеосинтеза (склеивания костей) принадлежит советским ученым.
С достижениями химии полимеров изменились и используемые в костной хирургии синтетические препараты. На смену механическому остеосинтезу полимерами появился адгезивный остеосинтез акриловыми производными, эпоксидными и полиуретановыми смолами и, наконец, цианоакрилатными композициями.
Первыми, как у нас в стране, так и за рубежом, для полимерного остеосинтеза начали использовать быстротвердеющие препараты на основе метилметакрилата (стиракрил, осакрил, палапоит, палавит, палакос и др.). С 1956 г. в СССР проводились широкие испытания отечественного эпоксидного препарата «Остеопласт», а двумя годами позже за рубежом появились первые сообщения о применении при операциях на костях препарата на основе полиуретана «Остамер» и эпоксидного клея «Агаldite АW-120». Однако уже в 60-х годах цианоакрилатные соединения (циакрин, М-2-Ц, истмэн-910, кодак, биобонд, Аpon-аlpha-А «Санкио» и др.), выгодно отличающиеся физико-химическими и биологическими свойствами, вытесняют своих предшественников.
Создание советскими учеными новых способов ускорения полимеризации с помощью ультразвука в значительной мере способствовало расширению возможностей применения цианоакрилатных композиций в костной хирургии.
Первая в мире научная работа «Остеосинтез и заполнение дефектов костей с помощью ультразвуковой сварки» была опубликована В. А. Поляковым в 1969 г., а в 1972 г. за разработку и применение в клинической практике методов ультразвукового соединения костей после переломов, ортопедических и торакальных операций, воссоздание костной ткани при заболеваниях и дефектах костей, а также ультразвуковой резки живых биологических тканей творческий коллектив в составе акад. АМН СССР М. В. Волкова, чл.-кор. АН СССР Г. А. Николаева, профессоров В. А. Полякова и В. И. Петрова, доцентов Г. Г. Чемянова и В. И. Лощилова был удостоен Государственной премии СССР.
Рассматривая проблему химического остеосинтеза, необходимо учитывать особенности протекания реакции полимеризации склеивающих препаратов (экзотермичность, скорость), прочность адгезии и когезии, их работоспособность во влажной среде.
Отвердение акрилатов, эпоксидных и полиуретановых препаратов сопровождается ярко выраженной экзотермической реакцией, существеннозависимой от соотношения компонентов, количества отвердителя или катализатора, от массы полимеризуемого препарата (рис. 20). При этом температура полимеризации превышает порог коагуляции белков, что сопровождается ожогами и некрозом окружающих полимер тканей.
Микробиологическими исследованиями установлены микробная загрязненность, преимущественно кокковой флорой, большинства порошкообразных полимеров и смол адгезивных препаратов и стерильность их мономеров и отвердителей.
В посевах со свежеприготовленных акрилатов, эпоксидов и полиуретанов определяется рост микробных колоний. Цианоакрилаты отличаются выраженными бактериостатическими и бактерицидными свойствами. Поэтому при использовании быстротвердеющих акрилатов, эпоксидных и полиуретановых препаратов для химического остеосинтеза необходима их тщательная стерилизация, а применение цианоакрилатов возможно без дополнительной их обработки.
Выделяют три основных способа химического остеосинтеза: интрамедуллярный (рис. 21, а), экстракортикальный (рис. 21,6) и интерпозиционный (рис. 21, в). Биомеханические параметры подтверждают возможность создания достаточно прочного соединения костных отломков при интрамедуллярном остеосинтезе акрилатами, эпоксидами и полиуретанами и при интерпозиционном остеосинтезе — цианоакрилатами. Однако заполнение мозговой полости длинных трубчатых костей жидким адгезивом является травматичным вмешательством. Совершенно необходимое высушивание и обезжиривание при подготовке костного ложа, адгезивная интимная связь препарата с ним на большом протяжении со стороны эндоста, экзотермичность полимеризации — все это неблагоприятно влияет на остеорепарацию. Кортикальная пластинка после интрамедуллярного химического остеосинтеза акрилатами, эпоксидами или полиуретанами, как правило, секвестрируется (рис. 22).
При экстракортикальном и интерпозиционном остеосинтезе отвердевший полимер является интерпозитом, препятствующим врастанию соединительной ткани и формированию костной мозоли. Только композиции на основе цианоакрилатов обладают бактерицидными свойствами при биодеструкции в тканях, способны рассасываться и замещаться костной тканью (рис. 23).
В настоящее время для химического остеосинтеза могут быть рекомендованы только цианоакрилатные композиции (МК-7, МК-9). Их использование может быть успешным при остеосинтезе мелких трубчатых костей, для фиксации ненагрузочных костных фрагментов, особенно при внутрисуставных переломах (рис. 24). Но при этом прочность фиксации весьма незначительна и наибольших своих значений достигает в течение 24-48 ч.
Адгезивный ультразвуковой остеосинтез.
Известны адсорбционно-молекулярная, электрическая, диффузионная и комбинированная теории адгезии полимеров. Механизмы адгезивного соединения чрезвычайно сложны и зависят от многих факторов: свойств адгезива, особенностей склеиваемых поверхностей, характера границы раздела «адгезив-субстрат».
Воздействуя химическими или физическими агентами (катализаторами, ингибиторами, теплом, давлением, током высокой частоты, оптическими квантовыми генераторами, ультразвуком и др.), возможно управление различными механизмами полимеризации мономеров. Весьма перспективным оказалось использование для этих целей ультразвука, механическое, физико-химическое и тепловое действие которого известны и широко используются в физиотерапии. Описаны обезболивающий, метаболический, антимикробный, стимулирующий остеорепарацию и другие положительные эффекты воздействия ультразвука на биологические ткани.
Новый метод адгезивного ультразвукового остеосинтеза начали разрабатывать в 1964 г. на кафедре травматологии ЦОЛИУВ В. А. Поляков и Г. Г. Чемянов и в МВТУ имени Н. Э. Баумана Г. А. Николаев и В. И. Лощилов. В 1967 и 1970 гг. Комитет по делам изобретений и открытий выдал авторские свидетельства СССР № 263074 и 312601 за разработку нового способа фиксации костей, названного авторами ультразвуковой сваркой, а Министерство здравоохранения СССР разрешило его использование в клинической практике.
Сущность ультразвуковой сварки костей (ультразвукового адгезивного остеосинтеза) заключается в том, что электрические колебания, вырабатываемые генератором, подают на обмотку магнитостриктора, который преобразует их в механические. Механические колебания трансформируются с помощью волновода-концентратора и передаются на смесь адгезивного цианоакрилатного мономера с наполнителем, помещенную в область перелома.
Под действием механических колебаний ускоряется полимеризация мономера и формируется полимерный конгломерат, соединяющий костные фрагменты. Целесообразно использование ультразвуковых установок типа УРСК-7Н или УЗГ-2-04 с рабочим диапазоном частот от 20 до 50 кГц и амплитудой механических колебаний торца волновода-концентратора 40—60 мкм. Введение энергии с помощью ультразвука в жидкий адгезивный мономер создает явления локальной кавитации, возникают акустические потоки, переменные колебательные ускорения и знакопеременные давления. Исследованиями с помощью электронного парамагнитного резонанса доказано, что при этом разрываются связи в мономере и образуются свободные радикалы, происходит перемешивание мономера, интенсификация процессов конвективной диффузии активных радикалов адгезива и тем самым ускоряется полимеризация цианоакрилатной композиции.
Под воздействием ультразвука повышается средняя глубина проникновения мономера в костную ткань, которая может достигать 150—200 мкм. При интенсивности ультразвука в зоне контакта с костью около 0,8—1 Вт/см2 температура в полимеризующемся конгломерате не превышает 50-70°С.
В качестве наполнителей возможно использование гранул или волокон аллогенной костной стружки, микрокапсулированных солей кальция и др.
Ускоренная полимеризация с помощью ультразвука при адгезивном остеосинтезе может обеспечивать быструю и достаточно прочную фиксацию костных отломков или осколков на операционном столе и снижение экспозиции относительно токсичного мономера-адгезива на раневые поверхности.
Адгезивный ультразвуковой остеосинтез сопровождается заполнением полостей, пор и каналов соединяемых костных поверхностей биополимерным конгломератом и формированием достаточно прочных механических и химических связей. Всякое действие характеризуется противодействием, и повышение прочности соединения неизбежно связано с изменением давления в пограничной с полимером зоне. Судьба биологических клеток и тканей, длительно находящихся под воздействием механического давления на большом протяжении контакта с полимером, известна — наступают необратимые трофические расстройства и они погибают. Следовательно, допустимым является адгезивное соединение с биологически целесообразной прочностью. Чем на большей поверхности выполняется адгезивный ультразвуковой остеосинтез, тем выше первоначальная прочность соединения, но и в большей степени выражены и раньше начинаются процессы отторжения, снижается прочность биополимерного конгломерата в живых тканях.
В сроки от 1 нед до 1,5 мес биополимерный конгломерат набухает, фрагментируется и отслаивается от материнского костного ложа (рис. 25), инкапсулируется фиброзной тканью. Его полное рассасывание и замещение протекают многие месяцы.
Остеогенетическая функция лиофилизированной аллогенной костной стружки при адгезивном ультразвуковом остеосинтезе не наблюдается.
Окруженные массами полимера ее фрагменты подвергаются некробиотическим изменениям, некротизируются и со временем постепенно резорбируются. Избыточная интерпозиция биополимерного конгломерата между раневыми поверхностями кости препятствует остеорепарации, в этих случаях наблюдается замедленная консолидация или формирование ложных суставов.
Воздействие механических колебаний непосредственно на костные отломки при адгезивном ультразвуковом остеосинтезе, по данным растровой электронной микроскопии, сопровождается локальным повреждением сосудисто-нервных окончаний в надкостнице, что клинически проявляется обезболивающим эффектом в ранние сроки после операции. Эти сенситивные изменения носят временный обратимый характер, и через несколько суток болевая чувствительность восстанавливается.
Результаты биомеханических исследований не позволяют рассчитывать на длительное сохранение прочности в процессе рассасывания и перестройки биополимерного конгломерата, первоначальная прочность которого не компенсируется за счет фиброзных волокон, прорастающих в полимер значительно позже его фрагментации. Следовательно, для активации репаративной регенерации костной ткани и сращения отломков костей их соединение должно быть выполнено на небольшом протяжении, а раневые поверхности костных фрагментов на большей части не разъединены массами биополимерного конгломерата.
Учитывая перечисленные факторы, правомочно выделить принципиально важные условия, соблюдение которых позволяет обеспечить реализацию основных требований оперативного соединения костных фрагментов при адгезивном ультразвуковом остеосинтезе. В первую очередь к ним следует отнести следующие:
1. Относительно небольшие нагрузки или смещающие усилия на область соединения отломков или осколков кости. Попытки адгезивного ультразвукового остеосинтеза длинных трубчатых костей в диафизарном отделе не оправданы и, как правило, обречены на неудачу.
2. Создание надежного контакта раневых поверхностей кости на большом протяжении при минимальной площади адгезивного ультразвукового соединения. Интерпозиция биополимерного конгломерата является препятствием для процессов репаративной регенерации и замедляет консолидацию отломков костей. Гидролиз и резорбция избыточных количеств биополимера в биологических тканях сопровождаются проявлениями местных токсических свойств цианоакрилатных композиций.
3. Обязательное сочетание адгезивного ультразвукового остеосинтеза с надежной внешней иммобилизацией на протяжении средних сроков сращения переломов. Исключение могут составлять случаи фиксации небольших костных фрагментов неопорных отделов кости при отсутствии смещающих нагрузок.
4. Обоснованное и целесообразное сочетание и комбинирование способов адгезивного ультразвукового остеосинтеза с известными оперативными способами фиксации костных отломков.
Основные показания для адгезивного ультразвукового остеосинтеза:
оперативное лечение оскольчатых внутрисуставных переломов, фиксация небольших костных трансплантатов при костной пластике, фиксация мелких и средних осколков к материнскому костному ложу в сочетании с основными видами остеосинтеза при многооскольчатых переломах, создание неподвижности и дополнительная фиксация при комбинированном остеосинтезе, временное замещение костных полостей.
Безусловно, что адгезивный ультразвуковой остеосинтез во всех случаях показан только тогда, когда применение уже испытанных и зарекомендовавших себя оперативных методов затруднено, невозможно или малоэффективно.
Методика адгезивного ультразвукового остеосинтеза.
После открытой репозиции костные фрагменты адаптируют и удерживают с помощью однозубых крючков, спиц или шила. На поверхности кости в кортикальной пластинке через линию перелома ультразвуковой пилой или долотом готовят 2 — 3 паза, в зависимости от протяженности и формы линии излома, на глубину 2 — 4 мм размерами от 10 х 2 до 20 х 6 мм. Гемостаз, высушивание и обезжиривание соединяемых костных поверхностей достигают наложением жгута и использованием марлевых тампонов со спиртом и эфиром.
После тщательной подготовки стенки костного ложа смачивают несколькими каплями мономера-адгезива, затем пазы заполняют смесью лиофилизированной аллогенной костной стружки с цианокрилатным мономером в соотношении 1:1 и, создавая контакт рабочей поверхности волновода-концентратора со смесью, последнюю «озвучивают» до образования твердого конгломерата. В результате этого мостик из отвердевшего биополимерного конгломерата достаточно прочно, не образуя большой интерпозиции между раневыми поверхностями, фиксируют костные фрагменты (рис. 26).
Результаты.
Использование адгезивного ультразвукового остеосинтеза по строгим показаниям позволяет получить хорошие анатомо-функциональные результаты (рис. 27, 28), особенно при оскольчатых внутрисуставных переломах. Его применение как самостоятельного метода фиксации костных фрагментов обеспечивает восстановление конгруэнтности суставных поверхностей, необходимую прочность в сочетании с внешней иммобилизацией для удержания костных осколков и тем самым способствует их консолидации в оптимальные сроки и ранней реабилитации больных. Отсутствует необходимость во 2-й операции — удалении металлических фиксаторов, сокращается срок стационарного лечения.
Комбинированный адгезивный ультразвуковой остеосинтез, когда отломки кости фиксируют металлическими конструкциями, а осколки — биополимерным конгломератом, значительно расширяет возможности и эффективность основных методов остеосинтеза, способствует их обездвиживанию и благоприятному течению репаративной регенерации, улучшает результаты оперативных вмешательств.
Сочетание адгезивного ультразвукового остеосинтеза одних из элементов многокомпонентных переломов, например в области локтевого, голеностопного или коленного суставов, с металлоостеосинтезом других костных отломков оправдано только при оскольчатых переломах, когда применение традиционных способов не представляется возможным.
Ошибки и осложнения.
Ошибки при адгезивном ультразвуковом остеосинтезе можно условно разделить на 3 основные группы: связанные с нарушением технологических процессов, техники оперативного вмешательства и медико-биологические ошибки.
Строгое соблюдение технологических процессов гарантирует прочность соединения костных фрагментов. При стабильной работе ультразвукового оборудования в оптимальном режиме первостепенное значение имеют: качество подготовки соединяемых поверхностей, соотношение и качество адгезива-мономера и костной стружки, длительность и характер «озвучивания», способ передачи энергии ультразвука и неподвижность соединяемых фрагментов до полной полимеризации.
Избыточное содержание в смеси мономера-адгезива повышает продолжительность полимеризации, а недостаточное смачивание наполнителя препятствует равномерной передаче ультразвуковых колебаний в толщу полимеризующегося конгломерата.
При недостаточной экспозиции «озвучивания» полимеризация происходит лишь на поверхности конгломерата. Излишне длительное воздействие сопровождается разогреванием рабочей части волновода-концентратора, вторичным размягчением первоначально отвердевшего конгломерата и повышением его липкости к операционным инструментам. В этом случае соединение получается непрочным и биополимерный конгломерат обугливается. Разница в экспозиции между этими нарушениями технологических параметров составляет от нескольких секунд до минуты в зависимости от общего объема полимеризуемой массы, контактного давления, геометрии и режима работы волновода-концентратора.
Большое значение имеет способ передачи энергии ультразвуковых колебаний. При длительном контакте волновода-концентратора в области перелома с пластинчатой костной тканью связь частично отвердевшего биополимерного конгломерата с костным ложем нарушается.
Ошибки оперативной техники заключаются в нецелесообразной последовательности этапов хирургического вмешательства при адгезивном ультразвуковом остеосинтезе, сочетающемся с остеосинтезом других элементов многокомпонентного перелома металлическими фиксаторами.
Нежелательные последствия медико-биологических ошибок связаны с недооценкой биологических особенностей репаративной регенерации при адгезивном ультразвуковом остеосинтезе. Наиболее типичные ошибки этой группы: распространение мономера-адгезива между раневыми поверхностями кости на большом протяжении с образованием биополимерного интерпозита; создание избыточных по массе и необоснованных по характеристикам прочности биополимерных конгломератов; попадание мономера, костной стружки или их смеси в окружающие мягкие ткани или в полость сустава; недостаточная внешняя иммобилизация и ранние нагрузки в послеоперационном периоде.
Среди возможных осложнений при адгезивном ультразвуковом остеосинтезе необходимо отметить местные воспалительные реакции в области биополимерного конгломерата, индивидуальную непереносимость у некоторых пациентов, асептическое воспаление и отторжение фрагментирующегося биополимерного конгломерата, нагноение операционной раны при нарушениях общих принципов асептики в хирургии. Общее количество осложнений не превышает 0,5-1,7%.
В настоящее время метод адгезивного ультразвукового остеосинтеза является достаточно сложным, и успешное его применение в высокоспециализированных травматолого-ортопедических учреждениях страны требует специальной подготовки и навыков от хирурга. В итоге, необходимо еще раз подчеркнуть, что по характеристикам прочности остеосинтез полимерами является репозиционным и требует искусного владения средствами иммобилизации.
С.С. Ткаченко
Подберём Вам бесплатно нужного врача-специалиста
Ирина 27.03.12, 21:52
Скажите, а Вы уверены, что спицы не медицинские? А если спицы медицинские,заводского изготовления, полученные вет клиникой №2 официально? Может быть это говорит о том, что Ваш комментарий некорректен? И это устранение конкурентов (см. клевета)?
Комментировать:
Похожие статьи:
Общие осложнения после остеосинтеза. Жировая эмболия
Категории: Остеосинтез, Осложнения при остеосинтезе,
Жировая эмболия развивается при переломах (чаще закрытых) костей таза, бедра, голени и особенно при множественных переломах костей. В связи с распространением жировых частиц в кровяном русле может..
Общие осложнения после остеосинтеза. Артриты
Категории: Остеосинтез, Осложнения при остеосинтезе,
Развитие инфекционных осложнений при ранениях и повреждениях суставов может создать угрозу для пострадавшей конечности и даже для жизни больного. Анатомическое строение и гистологическая структура..
Общие осложнения после остеосинтеза. Анаэробная инфекция (газовая гангрена)
Категории: Остеосинтез, Осложнения при остеосинтезе,
Анаэробная инфекция ран наблюдается очень редко, является одним из наиболее тяжелых осложнений остеосинтеза, дает высокий процент летальных исходов и часто вынуждает хирургов прибегать к ампутации. Хотя..
Общие осложнения после остеосинтеза. Остеомиелит
Категории: Остеосинтез, Осложнения при остеосинтезе,
Остеомиелит — гнойное воспаление всех элементов кости, сопровождающееся некрозом части ее. Причина развития посттравматического, послеоперационного остеомиелита — массивная травма с наличием..
Общие осложнения после остеосинтеза. Нагноение ран
Категории: Остеосинтез, Осложнения при остеосинтезе,
Гнойная инфекция ран является самым частым осложнением как внутреннего, так и чрескостного остеосинтеза. Клинические признаки ее развиваются в большинстве случаев в первые 5 — 6 дней после операции. В..
Чрескостный остеосинтез аппаратами при лечении множественных переломов
Категории: Остеосинтез, Методы и принципы остеосинтеза, Остеосинтез - другое,
Остеосинтез аппаратами открыл новые возможности в лечении множественных переломов [Никитин Г. Д. и др., 1976; Илизаров Г. А. и др., 1980; Швед С. И., Шагарев В. М., 1981; Seligson D., Роnе Н., 1982]...
Внутренний остеосинтез при лечении политравм
Категории: Остеосинтез, Методы и принципы остеосинтеза, Остеосинтез - другое,
Большое разнообразие видов переломов при политравме и значительные различия костей по своим формам и размерам не позволяют добиться прочного соединения отломков посредством лишь одного «универсального»..
Особенности остеосинтеза при лечении пострадавших с множественными и сочетанными переломами
Категории: Остеосинтез, Методы и принципы остеосинтеза, Остеосинтез - другое,
Оперативный метод является важнейшим звеном лечения множественных и сочетанных переломов костей в гораздо большей степени, чем при лечении одиночных переломов [Никитин Г. Д. и др., 1976; Бондарен-ко Н...
Шарнирно-дистракционные аппараты Аверкиева-Грицанова
Категории: Остеосинтез, Методы и принципы остеосинтеза, Остеосинтез при патологиях кости,
Чрескостный остеосинтез аппаратами внешней фиксации имеет значительные преимущества перед другими методами обездвиживания отломков. Однако лечение внутрисуставных переломов костей представляет большие..
Аппарат Ткаченко-Абушенко
Категории: Остеосинтез, Методы и принципы остеосинтеза, Остеосинтез при патологиях кости,
Аппарат Ткаченко — Абушенко состоит из 2 дуг, соединенных стержнями (рис. 95). В каждой дуге натягивают по 2 спицы, проведенные через сочленяющиеся кости. Боковые дистракционные стержни соединяются..
Общие осложнения после остеосинтеза. Жировая эмболия
Категории: Остеосинтез, Осложнения при остеосинтезе,
Жировая эмболия развивается при переломах (чаще закрытых) костей таза, бедра, голени и особенно при множественных переломах костей. В связи с распространением жировых частиц в кровяном русле может..
Общие осложнения после остеосинтеза. Артриты
Категории: Остеосинтез, Осложнения при остеосинтезе,
Развитие инфекционных осложнений при ранениях и повреждениях суставов может создать угрозу для пострадавшей конечности и даже для жизни больного. Анатомическое строение и гистологическая структура..
Общие осложнения после остеосинтеза. Анаэробная инфекция (газовая гангрена)
Категории: Остеосинтез, Осложнения при остеосинтезе,
Анаэробная инфекция ран наблюдается очень редко, является одним из наиболее тяжелых осложнений остеосинтеза, дает высокий процент летальных исходов и часто вынуждает хирургов прибегать к ампутации. Хотя..
Общие осложнения после остеосинтеза. Остеомиелит
Категории: Остеосинтез, Осложнения при остеосинтезе,
Остеомиелит — гнойное воспаление всех элементов кости, сопровождающееся некрозом части ее. Причина развития посттравматического, послеоперационного остеомиелита — массивная травма с наличием..
Общие осложнения после остеосинтеза. Нагноение ран
Категории: Остеосинтез, Осложнения при остеосинтезе,
Гнойная инфекция ран является самым частым осложнением как внутреннего, так и чрескостного остеосинтеза. Клинические признаки ее развиваются в большинстве случаев в первые 5 — 6 дней после операции. В..