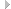Учебные материалы
Объявления
Конектбиофарм
Работа
Компании
|
|||
|
|||
|
Болевые миофиброзные проявления
Первые описания болевых мышечных синдромов были даны в 1843 г. немецким хирургом и патологом A.Froriep.
Для обозначения их применялись самые различные названия: ревматизм мягких тканей, ревматическая миальгия, мышечный ревматизм, миозит, фасцит, миофасцит, фиброзит, фибропатический синдром. K.Brown, A.Moritz (1961) опросили 110 американских хирургов, занимающихся такого рода больными. Эти врачи при оценке одних и тех же состояний пользовались 14 различными формулировками диагноза. В нашей стране после работ В.К.Хорошко (1927) и после опубликования в 1935 г. книги В.С.Марсовой многие употребляли термин «координаторный миопатоз» и, особенно в профпатологической литературе, «миофасцикулиты». W.Gowers в 1904 г. предложил вернуться к термину фиброзит, предложенному им ранее. Для фиброзита старых авторов характерны локальная болезненность не менее чем в 12 точках, утренняя тугоподвижность, течение — 3 месяца и более (Smith H.A., 1981). В английской и американской литературе предпочтительно пользуются термином «миофасциальный болевой синдром» (Travell J., Simons D., 1983). При подобного рода состояниях нет гематологических, общеинфекционно-соматических или гистологических признаков инфекционно-воспалительного процесса.
Среди ревматологов Л.В.Лауцевичус (1967), A.Briigger (1960) пользовались термином «тендомиоз», понимая под ним функциональное напряжение мышцы, сопровождающееся болью без уловимых в те годы гистологических или гуморальных изменений. Оно протекает остро и хронически.
Мышцы, соединительная ткань и их иннервация
Поперечно-полосатые мышцы вместе со связками и периартикулярными тканями составляют около половины массы человеческого тела. Они не только осуществляют и обеспечивают моторику, но и участвуют в разнообразных метаболических процессах. Напомним некоторые данные о морфологии и функции мышц в той мере, в какой это необходимо для понимания патогенеза рефлекторных нарушений в опорно-двигательном аппарате при остеохондрозе.
Деятельность мышцы сводится к сближению мест ее прикрепления: к пассивному напряжению при растяжении, при сокращении, когда мышца не в состоянии укоротиться (изометрическое сокращение, большая нагрузка); к активному напряжению, возникшему независимо от сокращения или нагрузки (последнее наблюдалось у человека со свободно висящими сухожилиями мышц: удавалось активное сокращение и активное напряжение без сокращения — PlautR., 1924). Растяжение мышцы происходит и при любом ее сокращении, начинаясь в лучше иннервируемой зоне брюшка мышцы при фиксированных концах. Это приводит к удлинению и натяжению крайних участков, которые уже оказываются растянутыми, когда волна возбуждения доходит до них. Разные части одной и той же мышцы могут быть различными по функции, поэтому существует понятие ак-тона — части мышцы, волокна которой распределены так, что создаваемые ими моменты силы относительно сустава всегда совпадают по направлению.
Каждый актон имеет в среднем 4 функции, а на одну степень свободы приходится 9 функций актона. При одном и том же укорочении мышечных волокон сухожилие у перистой мышцы переместится меньше, чем у лентообразной.
Взаимное расположение, форма и величина мышечных волокон различны в различных мышцах. Как раз в тех, на долю которых выпадает наиболее тяжелая работа (четырехглавая бедра, двуглавая плеча и др.), длина волокон не превышает 1/3 всей длины мышцы. Они располагаются косо между глубоко проникающими сухожильными тяжами. Вся мышца сокращается сразу по всей длине, и растяжение каких-либо участков невозможно. Упомянутое же растяжение краевых участков происходит в мышцах с параллельными волокнами при центральном расположении иннервационной зоны.
Вся мышца как орган снаружи одета соединительнотканным эпимизием, от которого внутрь отходят перегородки перимизия, окружающего пучок мышечных волокон, отделенных друг от друга эндомизием (рис. 3.14). Каркас эндомизия построен из пересекающихся элементов, образующих армирующую решетку. Эндомизий состоит из рыхлой соединительной ткани, содержащей аморфное вещество, коллагеновые волокна и фибробласты. В нем сеть капилляров оплетает каждое мышечное волокно. Лимфатических сосудов в нем нет.
Соединительнотканные перемычки мышцы обильно иннервируются рецепторами. Известно, что в фасциях плода они локализуются вблизи сосудистых петель (преимущественно колбы Краузе). Позже они пучкуются, к ним присоединяются свободные болевые рецепторы, которые с годами все больше ветвятся. Особенно много фатерпачиниевых колб. Они располагаются и в фасциальных нервных стволах, и в жировых дольках. Окончания становятся все более поливалентными. У стариков в рецепторах исчезают глиальные клетки, происходит распад терминалей, дезагрегация фибрилл (Ткачук В.А., 1963).
Мышечная клетка (волокно) одета прозрачной оболочкой — сарколеммой. Последняя по структуре подобна мембране нервной клетки и играет важную роль в возникновении и проведении возбуждения. Саркоплазма, заключенная в сарколемму, состоит из саркоплазматического матрикса — однородной среды, в которую погружены миофибриллы — сократимая субстанция саркоплазмы неживой природы и образующиеся из нее по мере превращения эмбриональных клеток (миобластов) в мышечное волокно. Одно волокно содержит до 1000 фибрилл. Последние представляют собой колонки, составленные из цилиндриков — тонких и толстых филаментов. Толстые филаменты темные, анизотропные, состоят из миозина, тонкие белые — изотропные, состоят из актина. Белки актин и миозин составляют акто-миозиновый комплекс, который под влиянием АТФ дает мышечное сокращение (Энгельгарт В.А., Любимова М.И., 1939; Szent-Gyorgyi A., 1964). Каждый тонкий цилиндрик (диск) делится пополам Z-линией. Участок мышечного волокна между двумя Z-линиями называется саркомером. Тонкий миофиламент по одну сторону Z-линии ориентирован в одном направлении, по другую — в противоположном.
В центральной области толстого цилиндрика тонкие и толстые миофиламенты не перекрывают друг друга. В двух половинах толстого цилиндрика (диска) актиновые филаменты движутся с двух сторон саркомера друг к другу, к его середине (рис. 3.15 а). Кроме того, в саркоплазме расположены миотрубочки: продольные, параллельные с филаментами, и поперечные. При сокращении мышцы укорачивается лишь анизотропное вещество. Оно разбухает в поперечном направлении благодаря поглощению воды. При растяжении мышцы анизотропное вещество удлиняется. При рабочей гипертрофии увеличивается саркоплазма, а не субстанция миофибрилл.
Ядра — центры питания, располагаются по оси волокна между фибриллами. Ядерный аппарат особенно богат в местах расположения нервных окончаний — в двигательной пластинке.
Соли, кислоты, щелочи и алкалоиды в малых дозах, равно как и охлаждение, понижают, а те же вещества в больших дозах, так же как и нагревание, повышают возбудимость мышцы. Ацетилхолин в малых дозах повышает возбудимость, а в больших дозах, давая сильное контрактурное сокращение, угнетает ее (Беритов И.С., 1947).
Под влиянием нервного импульса происходит кратковременная деполяризация мембраны нервного окончания, увеличивается проницаемость кальция внутрь окончания, что способствует резкому увеличению частоты выделения квантов ацетилхолина в синаптическую щель. Это приводит к увеличению проницаемости сарколеммы для ионов натрия и калия, к возникновению потенциала концевой пластинки.
Мышца сокращается тем скорее и интенсивнее, чем меньше она растянута, чем больше она отдохнула и чем выше ее температура. Растяжение происходит тем больше, чем сильнее ее тетаническое сокращение и чем больше ее утомление.
Принято судить о функции контрактильного аппарата по скорости развития изометрической тетанической активности. Считают, что это показатель скорости скольжения актиновых и миозиновых нитей, т.е. скорости образования их мостиков (Богданов Э.И., 1989). Однако указанные показатели связаны с функцией не одних лишь мышечных фибрилл.
Кроме активных контрактильных элементов в мышце имеются, как упомянуто выше, соединительнотканные упругие части — оболочки: эпимизий, перимизий и эндоми-зий (см. рис. 3.14). Подробнее на роли этих элементов мы остановимся в главе о патогенезе.
Электронное микроскопирование с одновременной регистрацией силы тяги и длины саркомера показало, что сила активных компонентов максимальна при наибольшем перекрытии активных участков актиномиозиновых филаментов и падает при уменьшении или при увеличении обшей длины мышцы, когда уменьшается или увеличивается расстояние между ее концами, т.е. когда уменьшается соответственно число поперечных мостиков, образующихся между миозиновыми и актиновыми нитями.
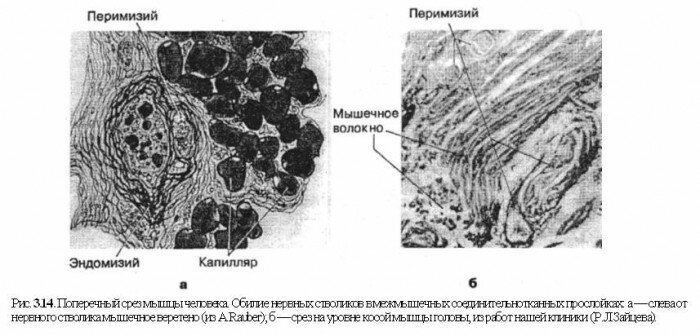
Как может миофибрилла передать в концах сарколеммы силу тяги большую, чем это позволяет ее механическая прочность? Два Z-диска соседних миофибрилл связаны продольными промежуточными миофиламентами. Они растяжимы. Тем не менее они не растягиваются, тогда как более прочные сухожилия удлиняются. Если бы механическая тяга передавалась вдоль мышечного волокна от саркомера к саркомеру, эти филаменты должны были бы подвергаться растяжению. Механическое напряжение сетки коллагеновых волокон при сокращении миофибрилл в случае передачи усилий вдоль саркомеров должно бы падать, а оно увеличивается в ходе сокращения. Кроме того, нет морфологически установленного перехода миофибрилл в сухожилие. Поэтому эстонский исследователь А.А.Вайн (1990) предложил принципиально новую функциональную модель скелетной мышцы (см. рис. 3.15). Автор подтвердил, что в результате скольжения актиновых и миозиновых нитей повышается внутримышечное давление и увеличивается периметр мышечных оболочек (Henkelom В. et al., 1979). Эти соединительнотканные структуры (сарколемма, перии эпимизий) содержат коллагеновые волокна. Волокна сарколеммы имеют решетчатую ориентацию, которая не позволяет увеличиться объему мышцы (Заалишвили М.М., 1971; Гурфинкель B.C., Левин Ю.С., 1985). Тяга устремляется вдоль мышцы пропорционально увеличению ее периметра. Она передается сухожилию не от малопрочного саркомера, а через эндо-, пери- и эпимизий, т.к. прочность соединительной ткани на порядок выше прочности миофибрилл. Т.к. сеть коллагеновых волокон в эндо-, пери- и эпимизий не позволяет увеличить объем, а содержимое, окруженное этими оболочками, можно рассматривать как несжимаемую вязкую жидкость, то в этих структурах возникает механическое напряжение, которое передается через эндо-, пери-и эпимизиум к сухожилию мышцы (см. рис. 3.15). Прежняя функциональная модель мышцы не объясняет ее биомеханические свойства: жесткость, демпферность, релаксационность и ползучесть. Эти свойства нереальны за счет поперечных мостиков. Новая же модель объясняет эти черты благодаря включению факторов эластичности соединительнотканных структур мышцы. Они аккумулируют энергию упругих деформаций при рекупурации (частичном возврате) энергии во время движения. Данная модель дала основание пересмотреть и некоторые стороны понятия мышечного напряжения, тонуса в условиях нормы и патологии, варианты сокращения (изометрического, кон- и эксцентрического) и пр. На этом мы остановимся после рассмотрения вопросов иннервации мышцы. Здесь же отметим, что R.Alexander, H.Bennet-Clark еще в 1977 г. отметили, что в ахилловом сухожилии может накапливаться потенциальной энергии упругой деформации больше, чем в икроножной мышце.
Нам представляется, что имеются косвенные данные о роли реализации и синкинетических реакций при вынужденных позах, при неблагоприятных двигательных стереотипах. Так, в норме при глубоком вдохе синкинетически напрягаются сгибатели шеи (голова как бы тянется к источнику кислорода). Оказалось, что временные показатели этой реакции нарушаются, если меняется упругость, плотность («гистерезис») выйной связки (JiroutJ., 1993).
Кривая сила-время может быть разделена на 4 зоны: 1) с медленным нарастанием напряжения (гофрированная структура коллагена — растяжение при растягивании); эта зона составляет 1-4% от начальной длины волокна; 2) с линейной зависимостью между приростами напряжения и удлинением — 2-5% от начальной длины сухожилия и 20-40% — у связок; 3) с первым повреждением волокон — нарушение линейной зависимости; предел прочности; 4) с резким падением напряжения из-за разрушения препарата. Препарат продолжает удлиняться, это удлинение называется ползучестью.

Рис. 3.16. Схематическое изображение мышечного веретена.
Модуль упругости Юнга изменяется по мере растяжения препарата. Механические свойства связок и сухожилий зависят от скорости растягивания: чем оно медленнее, тем меньше предельная нагрузка и энергия разрыва; при быстром растягивании развивается последующая релаксация. В процессе разминки теплопотери в сухожилиях уменьшаются, тренировки увеличивают сопротивление разрыву. Чем больше растянута мышца, тем менее она удлиняется при увеличении силы растяжения. При растягивании целой мышцы основное сопротивление оказывают соединительнотканные элементы. В активной мышце сила тяги равна сумме сил контрактильного и параллельного упругого компонентов. Еще ученик Галилея G.Borelli (1680) в книге «De motu animalium» показал, что сила сгибателей колена при разогнутом суставе составляет 51 фунт, при согнутом — 21 фунт: в активно растянутой мышце выступает действие соединительной ткани (чем длиннее мышца, тем больше сила, как и в пассивно растянутой мышце). Длина пассивной мышцы в покое (упругих сил нет) — это длина равновесная или свободная. Она чуть меньше естественной длины в живом теле.
Мышца иннервирована не только эфферентными, но и афферентными нервными окончаниями.
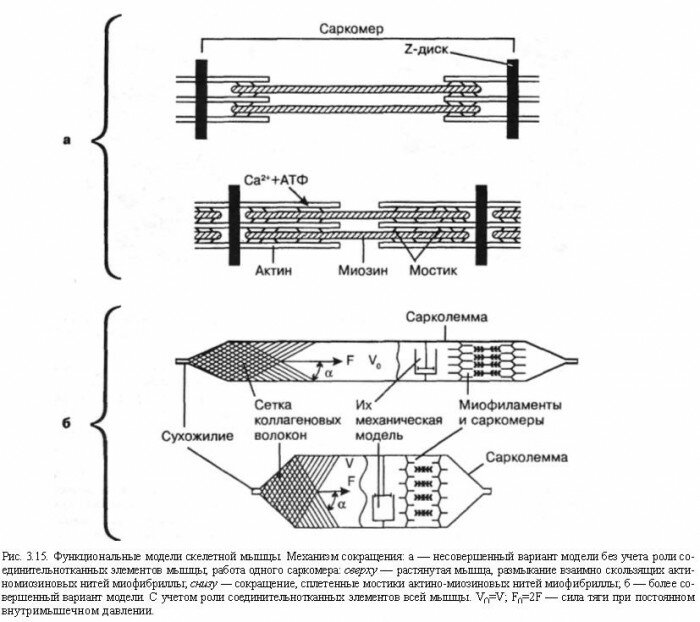
Более 100 лет назад, в 1863 г., Kiihne дал детальное гистологическое описание органов афферентной иннервации скелетной мускулатуры, назвав их нервно-мышечными веретенами (рис. 3.16). По свидетельству A.Ruffini (1898), рецепторы были впервые открыты Hassal в 1851 г. Вскоре C.Golgi (1870) сообщил о сухожильных рецепторах, после чего последовала серия работ о мышечных и других рецепторах (Чирьев С.И., 1870; Догель Е.С., 1897 и др.). Морфологические данные получили блестящее подтверждение и были развиты далее в трудах И.М.Сеченова (1863), C.S.Sherrington'a(1894).
Нервными окончаниями наиболее богато брюшко мышцы. В обычных условиях и сокращение начинается в лучше иннервированных отделах, а затем уже в других.
Запуск сокращения мышечного волокна происходит вследствие деполяризации его поверхностной мембраны. Затем деполяризуются его узкие инвагинации, образуемые мембранными ретикулярными выростами. Это служит сигналом для освобождения ионов Са2+ из саркоплазматичес-кого ретикулума, что ведет к увеличению концентрации в саркоплазме свободных ионов кальция, которые связываются с тропонином С. Это снимает блокирующее действие тропонин-тропомиозинового комплекса на актомиозино-вую систему волокна. Освобождаемый Са2+ откачивается обратно, реутилизируется в цистерны саркоплазматического ретикулума в результате работы Са-АТФазы. Поэтому в миоплазме концентрация ионов кальция уменьшается, он удаляется из тропомиозинового комплекса, и мышца расслабляется.
Активность сокращения зависит не только от кальциевой регуляции, но и от уровня фосфорилирования и дефосфорилирования легких цепей миозина.
Непосредственным источником энергии сокращения мышцы является анаэробное расщепление АТФ (АДФ, Р). Ресинтез АТФ обеспечивается креатинфосфатом через окисление. Для восстановления креатинфосфата требуется расщепление гликогена до молочной кислоты. В момент расслабления мышцы прекращается расщепление фосфорной и молочной кислот, причем молочная восстанавливается в гликоген.
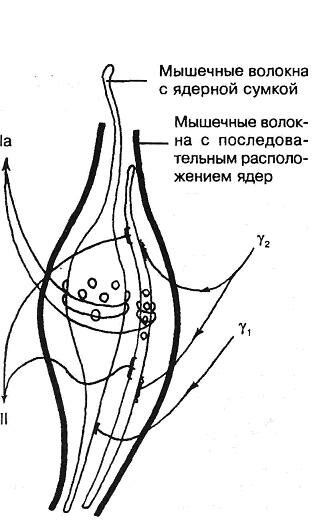
Рис. 3.17. Схематическое изображение мышечного веретена с двумя типами интрафузальных мышечных волокон. Слева — афферентные, справа — эфферентные нервные волокна (по Y.Korten, 1972).
О механизме раздражения мышечных рецепторов можно судить по рис. 3.17.
Из веретен, деформирующихся под влиянием сокращения и растяжения экстрафузальных волокон поперечно-полосатой мышцы, следует информация, направляющаяся через задний корешок в различные отделы центральной нервной системы.
Все эти данные послужили основанием для развития представления о собственных рефлексах мышцы, о стрэч-рефлексах. В последующем, с учетом данных о рецепторах сухожилий, периартикулярных и артикулярных тканей, возникло учение об артрогенных мышечно-тонических реакциях и контрактурах. Взгляды эти были широко использованы в клинике (Charcot J., 1886; Vulpian А., 1886; Корнилов А. А., 1895; Даркшевич Л.О., 1907; Вельяминов М.Я., 1924; Илютович Г.Е., 1951; Емельянов Л.Н., 1958; Лауцевичус Л.З., 1950, 1967, 1971 и др.).
После того, как P.Hoffman (1922) описал собственный рефлекс мышцы, это учение в 40-е годы обогатилось важными данными. Оказалось, что до сокращения мышцы, т.е. до механических воздействий на веретено, последнее получает по тонким волокнам — у-эфферентам L.Lexel (1945) — предварительную информацию о предстоящем сокращении. Опережая импульс, следующий по толстым волокнам переднего корешка к нервно-мышечной пластинке, к веретену «спешат» импульсы-курьеры, импульсы-предвестники. Когда же мышца сократилась, сигнал из афферентных окончаний веретена поступает в центр, неся информацию об этом.
Мнение о том, что ct-малые нейроны заканчиваются на красных мышечных волокнах, а сс-большие — на белых, фазических, оспаривается рядом авторов (Юсевич Ю.С., 1958 и др.). Если состояние у-эфферентов — важный периферический фактор формирования рефлекса на растяжение и рефлекторного тонуса, состояние а-малых нейронов — центральный фактор мышечного тонуса.
Серое вещество спинного мозга содержит большое количество поперечно расположенных аксонов афферентных и эфферентных волокон и их коллатералей, объединяющих как одноименные ядерные образования, так и другие группы нейронов. Именно эти структуры играют значительную роль в распространении процессов возбуждения и торможения по всему спинному мозгу (Микеладзе А.Л., 1965). Обнаружено небольшое число афферентных волокон, вступающих через передние корешки, которые оказались симпатическими.
Проприоспинальные связи обеих сторон поясничного и шейного утолщений осуществляются не только комиссуральными клетками 8 пластины Рекседа, но и клетками с длинными аксонами (Shimamura M., 1973). Описанные выше прямые и обратные связи мышцы обеспечивают не только проприоцептивную глубокую и другие сложные виды чувствительности, но и ряд рефлекторных процессов с участием разных уровней: сегментарных, ствола мозга, мозжечка, больших полушарий. Уже центральные нейроны первого порядка представляют собой своеобразные усилители афферентного потока — они генерируют разряды большей частоты и длительности, чем исходные (Костюк П.Г., I960 и др.). Благодаря их «спонтанной» активности, особенно в условиях благоприятствующих супраспинальных полисинаптических влияний, кратковременная афферентнаяимпульсация, поступающая из мышцы, способна вызвать не только фазический, но и длительный тонический центральный эффект. Этому, естественно, будут препятствовать как супраспинальное полисинаптическое торможение, так и торможение в первых звеньях тормозного устройства (Schmidt R., 1969; Сафьян В.И., 1976). Супраспинальные нисходящие тонические импульсы поступают по медленно проводящим кортико-руброспинальным волокнам, по ретикуло- и вестибулоспинальным путям.
Когда прекращаются облегчающие влияния из ретикулярной формации ствола и ослабевают рефлексы на растяжение, наступает атония спинального центра (Сорох-тин Т.Н., 1961). С прекращением же угнетающих влияний на эти рефлексы последние усиливаются, и тонус нарастает. Это происходит как за счет импульсов а-малых клеток, так и веретена: чертик из табакерки выскакивает не только потому, что снята крышка, но и потому, что действует внутренняя пружинка.
Изменения тонуса протекают различно в мышцах преимущественно белых и преимущественно красных.
Существование двух типов мышц известно со времени L.Ranvier (1880). Одиночное сокращение в красной мышце продолжается в течение 100-120 мс, тогда как в белой — 20-60 мс. Сокращение в красных мышцах в энергетическом отношении экономичнее, чем в белых.
У амфибий такое деление весьма обоснованно: существуют красные волокна, специализированные на медленной тонической деятельности, и белые волокна, специализированные на фазной деятельности. У человека такое деление имеет значение относительное.
При его рождении все волокна медленные. Дифференциация начинается в первые недели жизни. У взрослого можно говорить о преобладании преимущественно белых мышц и о наличии отдельных красных, например камбаловидных, и смешанных. Красный цвет обусловлен миоглобином, кровью сети капилляров и митохондриями, повышающими оптическую плотность. В такой мышце ритмическая стимуляция вызывает локальную деполяризацию — развиваются медленные напряжение и расслабление. Малые низкопороговые мотонейроны, иннервирующие медленные мышцы, работают уже при небольшом возбуждающем влиянии. Они способны к длительной ацетилхолиновой контрактуре (Kuffer S. et al, 1953; Сагдеев СБ., 1971) и обеспечивают слабое, но малоутомительное сокращение. В белой мышце даже одиночный импульс вызывает распространяющийся потенциал действия и сокращение. Для ее неэкономных волокон требуется большая частота раздражения. S.Cooper, J.Eccles (1930) установили в экспериментах на кошках, что при ритмической стимуляции слияние сокращений для камбаловидной мышцы составляет 30 импульсов в секунду, а для икроножной — 100. Согласно H.Henneman, C.Olson (1965), частоты раздражения, при которых наступает максимальное напряжение, т.е. гладкий тетанус, в медленной и быстрой мышце соответственно составляют 5-10 и 150 Гц. Я.М.Коц (1972) рекомендует определять характер мышцы человека (медленная или быстрая) с помощью слабого тетанического электрического раздражения. Время от начала движения до момента достижения максимальной амплитуды, т.е. период восходящей части кривой сокращения, равно как и время полурасслабления, указывает на «медлительность» или «быстроту» мышцы. Разделение мышечных волокон на 3 типа: А, В и С основывается на результатах исследований H.A.Padykula и его сотрудников (1958, 1962). Такое разделение удалось благодаря окраске волокон на гликоген, АТФ-азу, неспецифическую эстеразу и, в особенности, на сукцинатдегидрогеназу (СДГ). В темном спектре волокон красных мышц преобладает аэробный гликолиз, метаболизм, зависящий от кислорода, при низкой способности расщеплять гликоген и высоком липидном обмене. В светлом спектре волокон в белых мышцах преобладает анаэробный гликолиз. В медленной мышце весьма высока вязкость. Это препятствует проявлению силы при больших скоростях сокращения. Соответствующая кривая сила-скорость (Ward А., 1938; Wells J., 1965) показывает, что в такой мышце с нарастанием скорости сокращения сила падает значительнее, чем в быстрой мышце.
Схематические различия красных и белых мышц представлены в табл. 3.1.
Кроме фазных, в мышце имеются и тонические волокна. Иннервация красных мышц осуществляется тонкими нервными волокнами, что было установлено еще в 1901 г. (Hay J.). Значительно позже, когда была проведена рубрификация и нервных волокон — А, В, С (ErlangerJ., Gasser H., 1937), выяснилось, что красные мышечные волокна иннервируются а-малыми нервными волокнами (Eccles J., 1937, 1957). Чем толще нервное волокно, т.е. чем больше скорость проведения импульсов, тем больше скорость сокращения соответствующей мышцы (Bessou P. et al., 1963).
В а-малых нейронах, согласно D.Kernell (1966), больше общее сопротивление мембраны. Это означает, что под действием одних и тех же токов в них тоническая возбудимость больше, чем в крупных нейронах. У красных мышц, например камбаловидной, более низкий порог рефлекса на растяжение, чем у белых, т.е. у них более низкий порог на раздражение веретен. У спинальных животных активация мотонейронов медленных мышц вызывается легче, чем активация быстрых. Она происходит даже при раздражении аффе-рентов соседних мышц (Eccles J., Eccles R., 1957). Удецеребрированного животного красная камбаловидная мышца в ответ на растяжение дает напряжение, равное 90% своей максимальной тетанической активности, а икроножная — лишь 10% (Denny-Brown D., 1929).
Известно, что в скелетной мышце имеются не только рабочие экстрафузальные волокна, обеспечивающие движение и позу, но и интрафузальные волокна веретен, управляющие частотой их импульсного разряда. Эти последние, считавшиеся медленными, тоже оказались неоднородными: они бывают быстрыми и медленными (Smith К., 1966; Diete-Spiff К., 1967). Механическая реакция на небольшое напряжение быстрого интрафузального волокна млекопитающего сводится к значительному противодействию, а реакция медленного волокна выражается в смещении и медленном
восстановлении длины. Речь идет о поведении веретена с эластической сумкой, соединенной последовательно с весьма вязкой средой. Также и на тетаническое электрическое раздражение медленное интрафузальное волокно отвечает сокращением и расслаблением более медленным, чем быстрое интрафузальное. В веретенах выявляются и волокна с ядерной сумкой (ЯС) и с ядерной цепочкой (ЯЦ). Они различаются по длине лишь в крупных мышцах конечностей: около 7,5 мм в ЯС- и около 4 мм в ЯЦ-волокнах. После деафферентации ЯЦ-мышечные волокна веретен атрофируются, причем совершенно так же, как обычные экстрафузальные волокна. Следовательно, эти элементы рецепторов обладают и моторной иннервацией, которой не обладают никакие другие типы рецепторов.
Что касается моторной иннервации медленных и быстрых интрафузальных волокон, то еще Cipollone (1897-1898) утверждал, что сокращение интрафузальных мышечных волокон происходит под влиянием идущих к ним нервных импульсов, а не внешнего давления на капсулу. Вследствие же сокращения интрафузальных мышечных волокон, располагающихся в полярных частях веретен, последние и приходят в состояние возбуждения. Автор наблюдал дегенерацию тонких миелиновых волокон, направляющихся в составе передних корешков к интрафузальным мышечным волокнам. Здесь они заканчиваются кустовидно или концевыми пластинками. Особенностью расположения нервных волокон в икроножной мышце является малокалиберность и рассеянность пучков (Абдуллаев М.С., 1960). Камбаловидная мышца богата кислыми митохондриальными ферментами, сукцинатдегидрогеназой, а икроножная — фосфорилазой. При блокировании нервно-мышечной передачи трехглавой мышцы голени сублетальными дозами ботулинического токсина камбаловидная мышца оправляется от пареза быстрее, чем икроножная. В последней гистологические изменения в нервно-мышечных окончаниях остаются на несколько месяцев. Она надолго лишается окраски на фосфорилазу, тогда как камбаловидная реагирует на первых порах даже быстрее, чем в норме (Duchen L., 1970). Импульсы у-волокон предшествуют двигательным импульсам а-толстых волокон. Классические эксперименты L.Lexel (1945) показали, что такое раздражение тонких миелиновых у-волокон и сокращение интрафузальных волокон вызывает разряд в задних корешках. R.Granit (1973) допускает, что медленно нарастающее интрафузальное сокращение связано с активацией у-кустовидных окончаний. Мышечные веретена являются сенсомоторными регуляторами, и эта реакция, видимо, осуществляется дифференцированно через медленные и быстрые волокна.
Каким образом под влиянием нервных импульсов в самой мышце реализуется процесс сокращения?
Как следует из приведенной выше функциональной модели скелетной мышцы, ее соединительнотканные структуры находятся в состоянии определенного растяжения, внутримышечного давления. С приходом нервного импульса к имеющемуся напряжению прибавляется механическое напряжение в зависимости от количества преобразованной биохимической энергии в механическую.
Известны три формы мышечного сокращения: 1) изометрическая, когда мышца сохраняет свою длину; 2) концентрическая или миометрическая, изотоническая, с укорочением, выполнением положительной работы, в условиях, когда внешняя нагрузка меньше напряжения мышцы; 3) эксцентрическая или плиометрическая, когда мышца удлиняется, т.е. выполняется отрицательная работа, внешняя нагрузка больше напряжения мышцы, при этом чем больше вытянута мышца, тем менее она удлиняется при увеличении груза. Чаще имеет место смешанная форма — ауксотоническая, причем фаза напряжения короче фазы расслабления приблизительно вдвое. Демпфирование (глушение за счет потери энергии) выражено резко в сократительных элементах и слабо—в пассивно упругих. Что касается прочности связок и сухожилий, то она зависит от скорости их растягивания: чем выше эта скорость, тем больше нагрузка, требуемая для их разрыва. При растягивании целой мышцы наибольшее сопротивление оказывают соединительнотканные элементы.
Эти механизмы срабатывают при повышении тонуса всей мышцы. Они важны для понимания преходящего и устойчивого гипертонуса, контрактуры и отдельных участков мышцы.
На первых порах представления о мышечных уплотнениях складывались в понятиях коллоидной химии. Позднее стадии затвердения понимались как изменения коллоидов мышечного белка, переход от золя к гелю с консистенцией отвердевшего студня (миогелоз Schade Н., 1920; Lange М., 1931). Хотя оба автора описали эти образования независимо друг от друга, они дали общую оценку обнаруженным зонам мышечной резистентности. С помощью специального склерометра Н.Schade установил, что в норме различные мышцы отличаются по степени их плотности не более чем на 10%, тогда как в зонах миогелоза — до 50%. Уплотнения оставались и после новокаинизации и даже после смерти больных, отчетливо пальпируясь до наступления трупного окоченения. М.Lange пытался воспроизводить миогелозы в эксперименте путем стимуляции мышц бедра кролика и при местном замораживании. H.Strauss (1928) вслед за Гольдшейдером считал, что изменения эти связаны с холодом косвенно: холод вызывает вазомоторные сдвиги, анемию, затем венозный стаз. A.Schmidt (1910) определял в пораженных кусочках мышц повышенное кровенаполнение. Вследствие этого меняется и химизм мышцы. В ней накапливаются недоокисленные продукты, отмечается ацидоз (Good M., 1941, 1958), повышается содержание сукцинатде-гидрогеназы (Веселовский В. П., 1978; Хабиров Ф.А., 1991), повышается содержание хлоридов с относительным снижением содержания калия (Brendstrup Я. etai, 1957), накапливаются кинины (Kellenneyer F., 1968).
В условиях гипоксии происходит раздражение тучных клеток соединительной ткани, усиливается выделение ими гистамина и, следовательно, повышается проницаемость капилляров. Перицеллюлярные пространства увеличиваются. Тучные клетки выделяют гепарин, нейтрализующий гиалуронидазу, — накапливаются гиалуроновые кислоты (Drennan Y., 1951).
Видимо, существуют различные стадии развития и в самой группе «миогелозов». Нам приходилось наблюдать их переход в плотные образования бугристой консистенции, не поддающиеся разминанию. В таких случаях, наоборот, боли после массажа усиливались, что вполне понятно при обызвествлении очага миогелоза. Возможность перехода миогелоза в оссифицирующий миозит, как нам представляется, говорит в пользу того, что введение гипертонического раствора (видимо, не только натрия, но и кальция) патологически видоизменяет мышцу, нарушает состояние ее рецепторов и создает в ней триггерные зоны (см. ниже данные об экспериментальном формировании склеротомных болей).
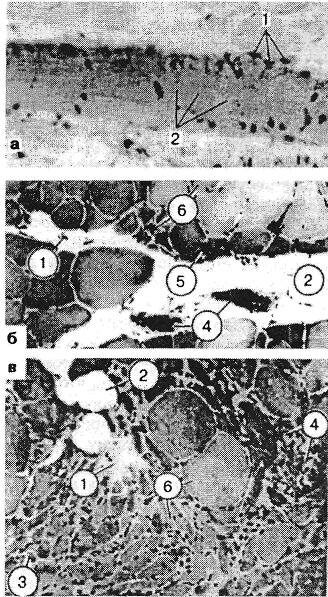
Рис. 3.18. Биоптаты из зон болезненного уплотнения, окраска гематоксилин-эозином: а — лестничная мышца, увеличение количества мышечных ядер (1), расщепление на отдельные диски (2); б и в — икроножная мышца больного остеохондрозом: 1 — участки фиброза перимизия; 2 — жировое замещение; 3 — группы и одиночные атрофированные волокна; 4 — участки воспаления вокруг некротизированных волокон; 5 — группа атрофированных волокон на площади целого фасцикула; 6 — дефицит волокон II типа.
Миофиброз, возникающий по тем же причинам, является наиболее частым вариантом завершающей стадии развития дистрофического процесса. Умеренная болезненность возникает при растяжении и меньше — при пальпации мышцы. Прощупываются плотные тяжи продолговатой формы. Тяжистость определяется во всей толще мышцы. Активное расслабление затруднено. Т.к. снижается эластичность, в отдельных случаях несколько ограничивается объем движений. Атрофии и снижения силы нет, т.к. необратимые изменения в одних фибриллах компенсируются гипертрофией других. Возможно осложнение надрывом мышц. В отличие от периартрозов, болезненность тканей незначительна, она возникает не при всех движениях в суставе.
При миогелозах M.Lange (I931) находил разрастание соединительной ткани, дегенерацию и разрежение мышечной.
G.Glogowski, J.Wollraff(1951) проводили биопсию у 20 больных с миогелозами и выявили восковидную дегенерацию мышечных волокон, их деструкцию, увеличение количества ядер, скопления их, жировую инфильтрацию. Авторы утверждали, что это определенная клинико-морфологическая форма. Различные результаты морфологических исследований определяются, по-видимому, не только выбором участка мышцы для биопсии, не только методикой исследования, но и стадией развития мышечных изменений.
В нашей клинике были подвергнуты гистологическому исследованию кусочки девяти передних лестничных мышц больных со скаленус-синдромом. Парафиновые срезы окрашивали гематоксилин-эозином и по ван Гизону (Кипер-вас И.П., Зайцева О.Л., 1967). При пальпации эти мышцы были плотны, болезненны и увеличены. Это подтверждалось и на операционном столе. Как показало гистологическое исследование, среди нормальной мышечной ткани имелись мышечные пучки неравномерной толщины и окраски. Часть их была гипертрофирована, часть — атрофична. Некоторые волокна были набухшими, гомогенными, без поперечной исчерченности, иногда со стертым фибриллярным строением. В ряде волокон, наоборот, миофибриллы были видны отчетливо, но расщеплены по длине с образованием узких щелей между отдельными пучками их. Встречались и волокна с явлениями очагового миолиза, глыбчатого и зернистого распада. В некоторых волокнах определялось поперечное расщепление на отдельные диски с увеличением количества мышечных ядер, в некоторых — вакуольная дистрофия.
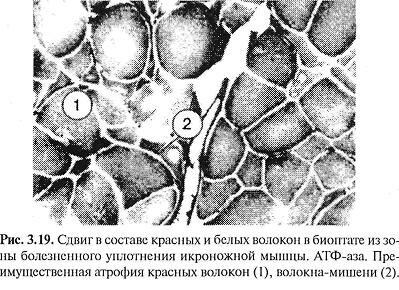
В участках измененных мышечных волокон соединительная ткань была разрыхлена, отечна, иногда с увеличением количества клеточных элементов и коллагеновых волокон, местами с переходом в фиброз и склероз. В таких участках мышечные волокна были раздвинуты. Соединительная ткань, богатая клеточными элементами, гистиоцитами, фибробластами и лимфоидными элементами, иногда имела рубцовый вид. В некоторых сосудах эндотелий был набухший, иногда пролиферирующий. Отмечалось утолщение стенок сосудов. В мышечных волокнах этих участков обнаруживались выраженные явления атрофии и дистрофии, в некоторых из них встречались многочисленные ядра и клетки (рис. 3.18). Подобные изменения были описаны затем и H.Tichy, K.Seidel (1969). Таким образом, вторая (органическая) стадия мышечно-болевого синдрома связана с различными дистрофическими изменениями: зернистый и глыбчатый распад, очаговый миолиз, дисковидный распад мышечных волокон, вакуольная дистрофия и пр., с переходом в фиброз и склероз. Биопсийный материал, взятый из болезненных мышечных уплотнений икроножной мышцы у 23 больных вертеброгенной люмбоишиальгией, также показал, что вслед за серозным пропитыванием наступают продуктивно-пролиферативные изменения. Обнаруживались группы одиночных атрофированных мышечных волокон, волокна-мишени, фиброз эндомизия, а в поздних стадиях — более грубый фиброз (Попелянский Я.Ю., Хаби-ровФ.А., 1993). Укороченная мышца теряет уровень диффе-ренцировки, происходит сдвиг в составе «медленных» и «быстрых» волокон (рис. 3.19).
J.Travell и D.Simons (1983) считают укорочение специфическим фактором активации курковых зон мышцы: длительное укорочение, например во сне, или внезапное, например при расслаблении укороченного агониста хлорэтилом.
Ограничение функции характерно как для активного, так и для латентного пунктов, спонтанная же боль — только для первого.
Белки мышечно-сухожильной ткани и болезненных мышечных узелков — зон нейроостеофиброза становятся аутоантигенами (Tichy Н., Seidel К., 1985; Попелянский Я.Ю., Веселовская О.И., 1985).
Перед тем как указать на малотравматические современные методики оценки состояния мышц при болевых синдромах, соответствующие данные целесообразно сопоставить с результатами экспериментальных исследований на животных.
С.С.Вайль (1967) вызвал перенапряжение мышц, вынуждая крыс плавать до изнеможения. При окраске мышц этих животных гематоксилин-эозином в поляризованном свете мышечные волокна определялись слегка извилистыми, саркоплазма образовывала горбовидные выбухания. В соответствующих участках анизотропные диски сливались, образуя сплошные двояколучепреломляющие фрагменты, что, по мнению автора, соответствует выраженным контрактурам. Подобные изменения находил наш сотрудник В.П.Веселовский после такого же типа перенапряжения мышц у подопытных животных. Другой группе крыс в латеральную головку икроножной мышцы вводилось 0,5 мл 10% раствора хлористого кальция. На втором месяце опыта в толще икроножной мышцы, чаще в месте начала обеих головок, выявлялась болезненность — животные реагировали на их пальпацию более бурно, чем на пальпацию других зон. Начиная с четвертого месяца, в медиальной головке мышцы обнаруживались постоянные участки уплотнения, и на той же конечности определялась кожная гипотермия. Здесь же на электромиограмме регистрировалось удлинение периода «успокоения» в ответ на погружение игольчатого электрода в мышцу. Выявлялась также нейрогуморальная декомпенсация в системе ацетилхолин-холинэстераза (гиперацетилхолинемия при снижении активности холинэстеразы), увеличивалась активность окислительно-восстановительных ферментов, лактатдегидрогеназы и сукцинатдегидрогеназы, снижалась активность ДПН-диафоразы (коэнзимы I и II, динуклеатиды фосфатные). Нарушения в указанных системах находились в прямой зависимости от выраженности уплотнений в мышцах.
В свете изложенного представляют интерес результаты исследований наших учеников по изучению обсуждаемой патологии мышц. В альгической фазе, когда объективные симптомы ограничиваются почти исключительно местными изменениями тонуса мышцы, интересные показатели нередко дает игольчатая электромиография. Обнаруживаются усиление и удлинение периода биоэлектрической активности погружения и усиление активности покоя. Появляется залпообразная активность покоя в ограниченных участках гипертонуса. В этот же период улавливаются и сдвиги тканевого клиренса (процента снижения радиоактивности в минуту) при введении изотопа в пораженную мышцу (Алябина Н.Е., Заславский Е.С., Ходич Т.Г. и соавш., 1973).
Что касается нейродистрофических влияний на мышцу и соединительную ткань, то на первых порах предполагалось, что они адресуются к сосудистому аппарату и реализуются через вазомоторику (Сеченов И.М., 1866; Бехтерев М., 1925; Brunning L., 1952). Одновременно на разных этапах изучения нейротрофики накапливались факты в пользу непосредственных нервнотрофических влияний.
В лаборатории С.П.Боткина его сотрудники С.В.Левашов (1880), а затем И.П.Павлов (1882,1883) наблюдали усиление функциональной активности стенки сосудов задней лапы и сердечной мышцы собаки при раздражении определенных нервов. Это в последующем (1892) позволило И.П.Павлову поддержать представление S.Magandie (1834), Samuel'a (1860) о наличии специальных трофических нервов. Эту рефлекторную функцию стали приписывать всей вегетативной или только симпатической (Орбели Л.А., 1938), или соматической нервной системе. В последнем случае одни авторы отдавали преимущество чувствительной (Wybum-Mason R., 1950; Грацианская A.M., 1956; Григорьева Т.А., 1959; Лебединский А.В., Нахильницкая З.Н., 1964), другие — двигательной иннервации (Gutman Е. et al, 1956, 1962; Гник П., 1958; Hollos G. et al., 1960; Felix W., 1962). Л.А.Орбели (1938) говорил о тономоторной функции симпатикуса, создающей почву для действий соматических тономоторных нервов. М.Р.Могендович отождествляет эту концепцию с представлением R.Granit (1957) о у-эфферентах.
В настоящее время большинство авторов признает, что трофическая функция осуществляется всей нервной системой, а нарушение трофики может возникнуть при повреждении любого ее отдела (Сперанский А.Д., 1936, 1952; Баяндуров Б. И., 1949; Коштоянц Х.С, 1951; Боровский М.Л., 1952, 1957; Зайко Н.Н., 1954; Бентелев A.M., Надежкин Л.В., 1959; Волкова О.В., 1970; Швалев В.К, 1971). Прямые трофические влияния дополняются влиянием симпатикуса на сосуды, питающие ткань через адренергические волокна (Говырин В.Н., 1967).
Эти общие теоретические представления о нейродистрофии позволили глубже оценить новые факты, полученные благодаря внедрению внутриклеточной регистрации электрических потенциалов, гистохимического и электронно-микроскопического методов, осмыслить изменения в клетках на молекулярном и субклеточном уровнях. Общие синтетического характера концепции не препятствовали выяснению интимных механизмов реализации трофических функций. В частности, продолжается раздельное изучение возбуждающего действия нерва, т.е. приводящего к мышечному сокращению, и трофического
Независимость трофического влияния нерва на мышцу от возбуждающих двигательных импульсов установлена в опытах инактивации мышц с помощью тенотомии, а также фиксации суставов (Chor Н., Dolkart R., 1936; Katpati G., 1968), изолирования отдела спинного мозга (Towwer, 1937), новокаиновых блокад нервного ствола (Gutmann E., 1962).
Электронно-микроскопические исследования показали уменьшение диаметра мышечных миофибрилл при всех видах атрофии (Wechsler W., 1966). Как в денервированной, так и в тенотомированной мышце, кроме того, снижается активность фосфорилирования из-за замедления ферментативно-фосфорилазной и фосфогексокиназной деятельности (Телепиева В.И., 1955). Нейрогенный вариант атрофии отличается от атрофии при инактивации большим темпом потери веса и более быстрым уменьшением диаметра мышечных волокон (Muscatello V., Patriarca P., 1968); наблюдается более резкое падение концентрации карнозина и креатина и более значительное увеличение содержания глутаминовой кислоты, чем при тенотомии (Юдаев НА. и др., 1953). Свободные Н-группы, появляющиеся в дегенерированной мышце, содержатся в меньшем количестве в тенотомированной (Попова М.Ф., 1956). Существенные различия обнаружены в содержании нуклеиновых кислот: значительное повышение уровня ДНК, отмечаемое в денервированной мышце, не происходит при тенотомии, что связывают с различиями в числе мышечных ядер (Hollos J. et al., 1960; Gutmann К, 1961, 1962). Содержание РНК в первые дни понижается больше в денервированной мышце, чем в тенотомированной (Hobos G. etal., 1960). Специфическим для денервированной мышцы является повышение ее чувствительности к медиаторам, особенно к ацетилхолину (Кеннон У., Розенблют Б., 1951), снижение уровня дыхания (Никитин В.Н. и др., 1956), повышение содержания воды, что не наблюдается в тенотомированных мышцах.
Регулярная электростимуляция обездвиженных мышц предохраняет их от атрофии и поддерживает нормальную мышечную силу (Кеннон У., Розенблют А., 1951). Электротерапия денервированных мышц задерживает атрофию на определенный период времени, сила сокращения при этом уменьшается, повышается чувствительность к ацетилхолину (Гинецинский А.Г., 1956), содержание ДНК не меняется (Gutmann Z, 1961). Авторы оценивают это как доказательство наличия специфического трофического влияния нерва.
Стало ясно, что нервная система регулирует метаболизм мышцы, воздействует на анаболические процессы. Трофическая функция нерва заключается в усилении послефункциональных восстановительных процессов. Об этом можно судить по тому, что в денервированной мышце после ее раздражения не усиливается процесс ресинтеза гликогена, не повышается синтез белков, не наблюдается усиления утилизации безбелкового азота и повышения потребления кислорода, как это происходит после раздражения нормальной мышцы.
Согласно гипотезе Е.Gutmann (1961), трофическое влияние нерва осуществляется путем транспортировки с током аксоплазмы определенного вещества, вырабатываемого нейроном.
Р.П.Женевская (1974) изучала пластические процессы мышечной ткани в условиях регенерации нерва в период до начала сократительной реакции мышцы в ответ на раздражение нерва. Установив факт трофического влияния нервана денервированную мышцу в тот период, когда в процессе регенерации еще не сформирован мионевральный синапс, автор приходит к следующему заключению: нерв в данных условиях, когда невозможна передача возбуждающего импульса (еще отсутствует мионевральный синапс), не функционирует как компонент нервной системы. Следовательно, обнаруженное трофическое влияние осуществляется самой тканью двигательного нерва.
При оценке результатов собственных экспериментов автор вслед за другими подтвердила, что трофическое влияние нервной системы заключается в передаче иннервируемым тканям нервно-трофических метаболитов, действующих по типу веществ, осуществляющих эмбриональную индукцию.
Обнаруженный исследователем факт задержки роста аутотрансплантатов и реиннервированных мышц в отсутствии проприоцепции дает основание считать, что подача нервно-трофических метаболитов мотонейронам контролируется системой обратных связей по афферентным путям, возможно, также с помощью передачи специфических веществ от мышечной ткани. Сейчас уже известно, что движение веществ по нерву осуществляется в обоих направлениях: обнаружен ток веществ не только от тела нейрона к периферии, но и от иннервируемой ткани к телу нейрона по микротрубочкам (Weiss J., 1969). Эти сведения связаны с довольно детально разработанным учением об аксоплазматическом токе.
Таким образом, существуют данные о роли афферентных путей из мышцы, обратных связей, регулирующих подачу нервно-трофических метаболитов мотонейронам.
В свете всего изложенного выше состояние кровоснабжения мышцы, ее обеспеченность кислородом приобретают новое значение. Отмеченная стадийность мышечно-трофических и нейродистрофических процессов заставляет нас вспомнить о стадийности сосудистых сдвигов в тех же тканях.
Известно, что первыми при ишемии страдают нервно-мышечные аппараты (Ходос Х.Г., 1940) при одновременной высокой чувствительности и сосудистых рецепторов к кислородному голоданию (Долго-Сабуров Б.А., 1956; Куприянов В.В., 1955 и др.).
Некоторые сведения о нейродистрофических сдвигах в условиях ишемизации тканей дали следующие эксперименты.
С.С.Трач и А.Р.Радзиевский (1970) перерезали артериальные магистрали и вводили в мышцы АТФ. При этом возникавшие атрофии были значительно меньше, чем при перерезке сосудов без введения АТФ. То же касалось и изменений в нервных структурах. Если без введения АТФ ишемизация ведет к распаду нервных окончаний вплоть до их фрагментирования, при введении АТФ грубых реактивно-дистрофических нарушений не было. Отмечались лишь реактивно-регенеративные изменения: вздутия и утолщения нервно-мышечных пластинок и разрастания шванновских структур. В саркоплазме вблизи нервно-мышечной пластинки уменьшалось количество митохондрий. Т.к. АТФ эффективен при введении его в ничтожно малых дозах, он действует на мышцу не непосредственно, а через нервно-мышечные приборы. В этой связи следует помнить основополагающие данные В.А.Энгельгарта (1939): миозин разлагается АТФ, а последняя и ее ферменты делают миозиновые волокна более растяжимыми.
Как ни велика роль гипоксии в описанных дистрофических процессах в мышечных и фиброзных тканях, влияния ее самой по себе недостаточно для объяснения нейромио-и нейроостеофиброза. В поисках других механизмов этих процессов было обращено внимание на то, что они развертываются: а) не только в связи с микротравматизацией (роль статико-динамических перегрузок при остеохондрозе); б) не только в связи с вазомоторными нарушениями; в) не только в связи с эфферентными импульсами, следующими по поврежденному корешку (роль компрессионных механизмов остеохондроза); г) не только в связи с эфферентными импульсами, следующими по здоровым нервным стволам из зон ирритации позвоночника и соответствующего квадранта тела (роль рефлекторных механизмов остеохондроза).
Было установлено, что тонические и нейродистрофические нарушения в мышечно-фиброзных тканях возникают нередко под влиянием ряда экзогенных факторов, обусловливающих аутоиммунизацию. Антигенные свойства, «чуже-родность» могут приобрести не только ткани, формировавшиеся изолированно от лимфоидной системы, как, например, выпавшие пульпозные ядра межпозвонковых дисков, но также, при определенных условиях, денатурированные белки любых тканей, в том числе мышечных и фиброзных периферических нервов.
Рассмотрение нейродистрофических изменений мышц невозможно без одновременного анализа соответствующих изменений их соединительнотканных элементов и соединительной ткани вообще. Миофиброз и нейроостеофиброз — это в такой степени связанные звенья одной патологической цепи, что можно считать целесообразным включение в понятие нейроостеофиброза и явления миофиброза. Не удивительно, что и другие терминологические попытки совершаются в направлении подобных же обобщений — например, миоэнтезиты... Перед тем как рассмотреть различные стороны патогенеза не только мышечно-тонических, но и миофиброзных дистрофических процессов и, в частности, их аутоиммунных механизмов, остановимся на некоторых особенностях соединительной ткани вообще.
И.И.Мечников (1892) высказал важные взгляды о роли клеток соединительной ткани в формировании иммунитета. Эти идеи получили дальнейшее развитие в трудах А.А. Богомольца (1936) о системе соединительной ткани. Она несет опорно-трофическую функцию, состоит из клеток, межклеточного аморфного вещества и волокнистых структур. Новообразование основного вещества соединительной ткани и ее коллагеновых волокон связано с жизнедеятельностью фибробластов. Биохимики установили сложную структуру главнейшего белка ткани волокнистых структур — коллагена. Гистохимия позволила более углубленно изучить группу коллагеновых заболеваний.
J.Nageott (1927, 1931), учитывая данные Эвальда о растворимости коллагена в слабокислой среде, а также способность его выпадать из раствора в форме фибрилл под влиянием солей, выдвинул биохимическую гипотезу образования коллагена. Согласно этой гипотезе, растворимый коллаген образуется из некоего белка крови, а затем осаждается под влиянием солей в коллаген. Гистологи разделяют данную концепцию, подчеркивая, что коллаген образуется из лреколлагена. Обе точки зрения примиряет А.А.Тустановский (I960), установивший, что растворимый коллаген является биохимическим предшественником коллагена,и этот предшественник они совместно с В.И.Ореховичем (1952) назвали проколлагеном (не путать с преколлагеном биохимиков). Т.к. в фибриллогенезе участвуют коллагеновые и неколлагеновые белки и мукополисахариды, коллаген рассматривают и как белково-мукополисахаридный комплекс (Jackson D. et ai, 1958). Морфологи, установив, что в коллагеногенезе первым этапом бывает преколлаген, своими методами не могли решить, пропитывается ли коллаген растворимым коллагеном или, деградируя, замещается вторым, или превращается в него биохимически. По точному замечанию АА.Тустановского, «...биохимики не изучали того, что видели морфологи, а морфологи не видели того, что предлагали видеть биохимики» (1960, с. 8). Г.В.Орловская и АЛ.Зайдес (1956) показали, что аргирофильный преколлаген эмбриональной закладки, не обладая рентгеноструктурными особенностями коллагена, со временем приобретает их. Оказалось, что белковая основа коллагена — комбинация двух белковых компонентов, один из которых — про-коллаген, другой — колластромин, который генетически связан с проколлагеном морфологов. Проколлаген и колластромин взаимодействуют по типу сочетания двух фаз: наружная фаза образована слоями проколлагена, внутренняя — нитями колластромина. В последних в дефинитивном коллагене сохраняется преколлаген как начальная фаза. Наименьшая структура единиц, содержащая обе фазы, — первичная коллагеновая фибрилла диаметром 500-1000 А. Эта единица одновременно морфологическая (на электронном уровне) и биохимическая. Каждая фаза содержит полисахариды, а колластроминовая — еще и глобулярные белки. Она занимает 80% свежего веса коллагена. Коллаген не идентичен волокну, он первичная коллагеновая фибрилла, элемент коллагенового волокна, но уже является многофазной и многокомпонентной системой (Зай-десА.Л., 1960). Образование компонентов коллагена, способы их сочетания остаются в области биохимии. Образование же коллагенового волокна — область фибриллогенеза. Коллагенообразование — стадия волокнообразования. Эластичные волокна также состоят из коллагеновых, только очень тонких, фибрилл. В них также имеются мукополисахариды. Кроме того, из них выделен белок эластин.
Применительно к остеохондрозу важно, что образование коллагена нарушается при С-авитаминозе. McCormick (1954) подчеркивает, что при этом нарушается синтез коллагена в тканях диска, т.е. наступает дистрофия фиброзного кольца. Потребление оптимального количества витамина С является фактором сохранения целостности межпозвонкового диска (Greenwood J., 1964). В.Б.Киселев (1971) у больных остеохондрозом выявил С-витаминную недостаточность, характерную для них во все сезоны года. Недостаток аскорбиновой кислоты влияет на выработку проколлагена (Орехович В.Н., 1952) и полисахаридов, участвующих в его формировании.
Важными для регуляции коллагенообразования и других функций соединительной ткани являются гормональные факторы, в первую очередь состояние системы гипофиз — кора надпочечников. Введение АКТГ, глюкокортикоидов, гормона щитовидной железы угнетает размножение фибробластов, задерживает развитие грануляционной ткани. Противоположное действие оказывает соматотропный гормон. Тестостерон стимулирует образование основного вещества и способствует аккумуляции в нем серы.
В старости известны атрофические изменения коллагеновых волокон при увеличении эластина, в частности в коже. В основном веществе соединительной ткани количество кислых мукополисахаридов уменьшается, накапливаются мукопротеиды, нарушаются процессы диффузии и ухудшается питание клеток, прогрессируют дистрофические процессы. Такие изменения А.В.Мельченко и соавт. (1965) отмечали и в дистрофичных межпозвонковых дисках.
В патологических условиях при бесклеточных склерозах (Абрикосов А.И., Струков А. И., 1953, 1954) вместо оформленных преколлагеновых волокон образуются аргирофиль-ные белково-полисахаридные массы, на которых неупорядоченно откладывается проколлаген. При разрастании соединительной ткани с участием клеток преколлагеновые аргирофильные волокна претерпевают преобразование по эмбриональному типу. При коллагеновых болезнях наблюдается дезорганизация коллагеновых волокон.
Под разрешающим воздействием экзогенных факторов сами по себе денатурированные белки соединительной ткани могут стать внутренним источником реактивных, в частности, аутоиммунных процессов. Аллергический же фактор, как показали О.Я.Острый и З.И.Собиева (1961), А.И.Зайко (1970) и др., является одним из компонентов неврогенной дистрофии. Другими словами, компонентом нейроостеофиброза являются и аутоиммунные реакции, включающиеся в нейрогенный дистрофический процесс при остеохондрозе. Этот процесс, таким образом, зависит и от особенностей взаимодействия аутоантигенов с соответствующими антителами.
А.Д.Адо (1970) классифицирует антитела по трем категориям: 1) агрессивные (с цитотоксическим повреждающим действием на клетки и ткани); 2) аутоантитела-свидетели (без агрессивных свойств), наличие которых выявляется серологическими реакциями и указывает на факт воздействия аутоантигенов; 3) защитные аутоантитела, способствующие выздоровлению организма от аутоиммунного заболевания и переходу аутосенсибилизации в состояние резистентности к данному тканевому раздражителю. Они также транспортируют к местам выделения и обезвреживают постоянно возникающие продукты распада клеток совершенно здорового организма.
Я.Ю.Попелянский
Ортопедическая неврология (вертеброневрология)

Для обозначения их применялись самые различные названия: ревматизм мягких тканей, ревматическая миальгия, мышечный ревматизм, миозит, фасцит, миофасцит, фиброзит, фибропатический синдром. K.Brown, A.Moritz (1961) опросили 110 американских хирургов, занимающихся такого рода больными. Эти врачи при оценке одних и тех же состояний пользовались 14 различными формулировками диагноза. В нашей стране после работ В.К.Хорошко (1927) и после опубликования в 1935 г. книги В.С.Марсовой многие употребляли термин «координаторный миопатоз» и, особенно в профпатологической литературе, «миофасцикулиты». W.Gowers в 1904 г. предложил вернуться к термину фиброзит, предложенному им ранее. Для фиброзита старых авторов характерны локальная болезненность не менее чем в 12 точках, утренняя тугоподвижность, течение — 3 месяца и более (Smith H.A., 1981). В английской и американской литературе предпочтительно пользуются термином «миофасциальный болевой синдром» (Travell J., Simons D., 1983). При подобного рода состояниях нет гематологических, общеинфекционно-соматических или гистологических признаков инфекционно-воспалительного процесса.
Среди ревматологов Л.В.Лауцевичус (1967), A.Briigger (1960) пользовались термином «тендомиоз», понимая под ним функциональное напряжение мышцы, сопровождающееся болью без уловимых в те годы гистологических или гуморальных изменений. Оно протекает остро и хронически.
Мышцы, соединительная ткань и их иннервация
Поперечно-полосатые мышцы вместе со связками и периартикулярными тканями составляют около половины массы человеческого тела. Они не только осуществляют и обеспечивают моторику, но и участвуют в разнообразных метаболических процессах. Напомним некоторые данные о морфологии и функции мышц в той мере, в какой это необходимо для понимания патогенеза рефлекторных нарушений в опорно-двигательном аппарате при остеохондрозе.
Деятельность мышцы сводится к сближению мест ее прикрепления: к пассивному напряжению при растяжении, при сокращении, когда мышца не в состоянии укоротиться (изометрическое сокращение, большая нагрузка); к активному напряжению, возникшему независимо от сокращения или нагрузки (последнее наблюдалось у человека со свободно висящими сухожилиями мышц: удавалось активное сокращение и активное напряжение без сокращения — PlautR., 1924). Растяжение мышцы происходит и при любом ее сокращении, начинаясь в лучше иннервируемой зоне брюшка мышцы при фиксированных концах. Это приводит к удлинению и натяжению крайних участков, которые уже оказываются растянутыми, когда волна возбуждения доходит до них. Разные части одной и той же мышцы могут быть различными по функции, поэтому существует понятие ак-тона — части мышцы, волокна которой распределены так, что создаваемые ими моменты силы относительно сустава всегда совпадают по направлению.
Каждый актон имеет в среднем 4 функции, а на одну степень свободы приходится 9 функций актона. При одном и том же укорочении мышечных волокон сухожилие у перистой мышцы переместится меньше, чем у лентообразной.
Взаимное расположение, форма и величина мышечных волокон различны в различных мышцах. Как раз в тех, на долю которых выпадает наиболее тяжелая работа (четырехглавая бедра, двуглавая плеча и др.), длина волокон не превышает 1/3 всей длины мышцы. Они располагаются косо между глубоко проникающими сухожильными тяжами. Вся мышца сокращается сразу по всей длине, и растяжение каких-либо участков невозможно. Упомянутое же растяжение краевых участков происходит в мышцах с параллельными волокнами при центральном расположении иннервационной зоны.

Вся мышца как орган снаружи одета соединительнотканным эпимизием, от которого внутрь отходят перегородки перимизия, окружающего пучок мышечных волокон, отделенных друг от друга эндомизием (рис. 3.14). Каркас эндомизия построен из пересекающихся элементов, образующих армирующую решетку. Эндомизий состоит из рыхлой соединительной ткани, содержащей аморфное вещество, коллагеновые волокна и фибробласты. В нем сеть капилляров оплетает каждое мышечное волокно. Лимфатических сосудов в нем нет.
Соединительнотканные перемычки мышцы обильно иннервируются рецепторами. Известно, что в фасциях плода они локализуются вблизи сосудистых петель (преимущественно колбы Краузе). Позже они пучкуются, к ним присоединяются свободные болевые рецепторы, которые с годами все больше ветвятся. Особенно много фатерпачиниевых колб. Они располагаются и в фасциальных нервных стволах, и в жировых дольках. Окончания становятся все более поливалентными. У стариков в рецепторах исчезают глиальные клетки, происходит распад терминалей, дезагрегация фибрилл (Ткачук В.А., 1963).
Мышечная клетка (волокно) одета прозрачной оболочкой — сарколеммой. Последняя по структуре подобна мембране нервной клетки и играет важную роль в возникновении и проведении возбуждения. Саркоплазма, заключенная в сарколемму, состоит из саркоплазматического матрикса — однородной среды, в которую погружены миофибриллы — сократимая субстанция саркоплазмы неживой природы и образующиеся из нее по мере превращения эмбриональных клеток (миобластов) в мышечное волокно. Одно волокно содержит до 1000 фибрилл. Последние представляют собой колонки, составленные из цилиндриков — тонких и толстых филаментов. Толстые филаменты темные, анизотропные, состоят из миозина, тонкие белые — изотропные, состоят из актина. Белки актин и миозин составляют акто-миозиновый комплекс, который под влиянием АТФ дает мышечное сокращение (Энгельгарт В.А., Любимова М.И., 1939; Szent-Gyorgyi A., 1964). Каждый тонкий цилиндрик (диск) делится пополам Z-линией. Участок мышечного волокна между двумя Z-линиями называется саркомером. Тонкий миофиламент по одну сторону Z-линии ориентирован в одном направлении, по другую — в противоположном.
В центральной области толстого цилиндрика тонкие и толстые миофиламенты не перекрывают друг друга. В двух половинах толстого цилиндрика (диска) актиновые филаменты движутся с двух сторон саркомера друг к другу, к его середине (рис. 3.15 а). Кроме того, в саркоплазме расположены миотрубочки: продольные, параллельные с филаментами, и поперечные. При сокращении мышцы укорачивается лишь анизотропное вещество. Оно разбухает в поперечном направлении благодаря поглощению воды. При растяжении мышцы анизотропное вещество удлиняется. При рабочей гипертрофии увеличивается саркоплазма, а не субстанция миофибрилл.
Ядра — центры питания, располагаются по оси волокна между фибриллами. Ядерный аппарат особенно богат в местах расположения нервных окончаний — в двигательной пластинке.
Соли, кислоты, щелочи и алкалоиды в малых дозах, равно как и охлаждение, понижают, а те же вещества в больших дозах, так же как и нагревание, повышают возбудимость мышцы. Ацетилхолин в малых дозах повышает возбудимость, а в больших дозах, давая сильное контрактурное сокращение, угнетает ее (Беритов И.С., 1947).
Под влиянием нервного импульса происходит кратковременная деполяризация мембраны нервного окончания, увеличивается проницаемость кальция внутрь окончания, что способствует резкому увеличению частоты выделения квантов ацетилхолина в синаптическую щель. Это приводит к увеличению проницаемости сарколеммы для ионов натрия и калия, к возникновению потенциала концевой пластинки.
Мышца сокращается тем скорее и интенсивнее, чем меньше она растянута, чем больше она отдохнула и чем выше ее температура. Растяжение происходит тем больше, чем сильнее ее тетаническое сокращение и чем больше ее утомление.
Принято судить о функции контрактильного аппарата по скорости развития изометрической тетанической активности. Считают, что это показатель скорости скольжения актиновых и миозиновых нитей, т.е. скорости образования их мостиков (Богданов Э.И., 1989). Однако указанные показатели связаны с функцией не одних лишь мышечных фибрилл.
Кроме активных контрактильных элементов в мышце имеются, как упомянуто выше, соединительнотканные упругие части — оболочки: эпимизий, перимизий и эндоми-зий (см. рис. 3.14). Подробнее на роли этих элементов мы остановимся в главе о патогенезе.
Электронное микроскопирование с одновременной регистрацией силы тяги и длины саркомера показало, что сила активных компонентов максимальна при наибольшем перекрытии активных участков актиномиозиновых филаментов и падает при уменьшении или при увеличении обшей длины мышцы, когда уменьшается или увеличивается расстояние между ее концами, т.е. когда уменьшается соответственно число поперечных мостиков, образующихся между миозиновыми и актиновыми нитями.
Как может миофибрилла передать в концах сарколеммы силу тяги большую, чем это позволяет ее механическая прочность? Два Z-диска соседних миофибрилл связаны продольными промежуточными миофиламентами. Они растяжимы. Тем не менее они не растягиваются, тогда как более прочные сухожилия удлиняются. Если бы механическая тяга передавалась вдоль мышечного волокна от саркомера к саркомеру, эти филаменты должны были бы подвергаться растяжению. Механическое напряжение сетки коллагеновых волокон при сокращении миофибрилл в случае передачи усилий вдоль саркомеров должно бы падать, а оно увеличивается в ходе сокращения. Кроме того, нет морфологически установленного перехода миофибрилл в сухожилие. Поэтому эстонский исследователь А.А.Вайн (1990) предложил принципиально новую функциональную модель скелетной мышцы (см. рис. 3.15). Автор подтвердил, что в результате скольжения актиновых и миозиновых нитей повышается внутримышечное давление и увеличивается периметр мышечных оболочек (Henkelom В. et al., 1979). Эти соединительнотканные структуры (сарколемма, перии эпимизий) содержат коллагеновые волокна. Волокна сарколеммы имеют решетчатую ориентацию, которая не позволяет увеличиться объему мышцы (Заалишвили М.М., 1971; Гурфинкель B.C., Левин Ю.С., 1985). Тяга устремляется вдоль мышцы пропорционально увеличению ее периметра. Она передается сухожилию не от малопрочного саркомера, а через эндо-, пери- и эпимизий, т.к. прочность соединительной ткани на порядок выше прочности миофибрилл. Т.к. сеть коллагеновых волокон в эндо-, пери- и эпимизий не позволяет увеличить объем, а содержимое, окруженное этими оболочками, можно рассматривать как несжимаемую вязкую жидкость, то в этих структурах возникает механическое напряжение, которое передается через эндо-, пери-и эпимизиум к сухожилию мышцы (см. рис. 3.15). Прежняя функциональная модель мышцы не объясняет ее биомеханические свойства: жесткость, демпферность, релаксационность и ползучесть. Эти свойства нереальны за счет поперечных мостиков. Новая же модель объясняет эти черты благодаря включению факторов эластичности соединительнотканных структур мышцы. Они аккумулируют энергию упругих деформаций при рекупурации (частичном возврате) энергии во время движения. Данная модель дала основание пересмотреть и некоторые стороны понятия мышечного напряжения, тонуса в условиях нормы и патологии, варианты сокращения (изометрического, кон- и эксцентрического) и пр. На этом мы остановимся после рассмотрения вопросов иннервации мышцы. Здесь же отметим, что R.Alexander, H.Bennet-Clark еще в 1977 г. отметили, что в ахилловом сухожилии может накапливаться потенциальной энергии упругой деформации больше, чем в икроножной мышце.
Нам представляется, что имеются косвенные данные о роли реализации и синкинетических реакций при вынужденных позах, при неблагоприятных двигательных стереотипах. Так, в норме при глубоком вдохе синкинетически напрягаются сгибатели шеи (голова как бы тянется к источнику кислорода). Оказалось, что временные показатели этой реакции нарушаются, если меняется упругость, плотность («гистерезис») выйной связки (JiroutJ., 1993).
Кривая сила-время может быть разделена на 4 зоны: 1) с медленным нарастанием напряжения (гофрированная структура коллагена — растяжение при растягивании); эта зона составляет 1-4% от начальной длины волокна; 2) с линейной зависимостью между приростами напряжения и удлинением — 2-5% от начальной длины сухожилия и 20-40% — у связок; 3) с первым повреждением волокон — нарушение линейной зависимости; предел прочности; 4) с резким падением напряжения из-за разрушения препарата. Препарат продолжает удлиняться, это удлинение называется ползучестью.

Рис. 3.16. Схематическое изображение мышечного веретена.
Модуль упругости Юнга изменяется по мере растяжения препарата. Механические свойства связок и сухожилий зависят от скорости растягивания: чем оно медленнее, тем меньше предельная нагрузка и энергия разрыва; при быстром растягивании развивается последующая релаксация. В процессе разминки теплопотери в сухожилиях уменьшаются, тренировки увеличивают сопротивление разрыву. Чем больше растянута мышца, тем менее она удлиняется при увеличении силы растяжения. При растягивании целой мышцы основное сопротивление оказывают соединительнотканные элементы. В активной мышце сила тяги равна сумме сил контрактильного и параллельного упругого компонентов. Еще ученик Галилея G.Borelli (1680) в книге «De motu animalium» показал, что сила сгибателей колена при разогнутом суставе составляет 51 фунт, при согнутом — 21 фунт: в активно растянутой мышце выступает действие соединительной ткани (чем длиннее мышца, тем больше сила, как и в пассивно растянутой мышце). Длина пассивной мышцы в покое (упругих сил нет) — это длина равновесная или свободная. Она чуть меньше естественной длины в живом теле.
Мышца иннервирована не только эфферентными, но и афферентными нервными окончаниями.
Более 100 лет назад, в 1863 г., Kiihne дал детальное гистологическое описание органов афферентной иннервации скелетной мускулатуры, назвав их нервно-мышечными веретенами (рис. 3.16). По свидетельству A.Ruffini (1898), рецепторы были впервые открыты Hassal в 1851 г. Вскоре C.Golgi (1870) сообщил о сухожильных рецепторах, после чего последовала серия работ о мышечных и других рецепторах (Чирьев С.И., 1870; Догель Е.С., 1897 и др.). Морфологические данные получили блестящее подтверждение и были развиты далее в трудах И.М.Сеченова (1863), C.S.Sherrington'a(1894).
Нервными окончаниями наиболее богато брюшко мышцы. В обычных условиях и сокращение начинается в лучше иннервированных отделах, а затем уже в других.
Запуск сокращения мышечного волокна происходит вследствие деполяризации его поверхностной мембраны. Затем деполяризуются его узкие инвагинации, образуемые мембранными ретикулярными выростами. Это служит сигналом для освобождения ионов Са2+ из саркоплазматичес-кого ретикулума, что ведет к увеличению концентрации в саркоплазме свободных ионов кальция, которые связываются с тропонином С. Это снимает блокирующее действие тропонин-тропомиозинового комплекса на актомиозино-вую систему волокна. Освобождаемый Са2+ откачивается обратно, реутилизируется в цистерны саркоплазматического ретикулума в результате работы Са-АТФазы. Поэтому в миоплазме концентрация ионов кальция уменьшается, он удаляется из тропомиозинового комплекса, и мышца расслабляется.
Активность сокращения зависит не только от кальциевой регуляции, но и от уровня фосфорилирования и дефосфорилирования легких цепей миозина.
Непосредственным источником энергии сокращения мышцы является анаэробное расщепление АТФ (АДФ, Р). Ресинтез АТФ обеспечивается креатинфосфатом через окисление. Для восстановления креатинфосфата требуется расщепление гликогена до молочной кислоты. В момент расслабления мышцы прекращается расщепление фосфорной и молочной кислот, причем молочная восстанавливается в гликоген.

Рис. 3.17. Схематическое изображение мышечного веретена с двумя типами интрафузальных мышечных волокон. Слева — афферентные, справа — эфферентные нервные волокна (по Y.Korten, 1972).
О механизме раздражения мышечных рецепторов можно судить по рис. 3.17.
Из веретен, деформирующихся под влиянием сокращения и растяжения экстрафузальных волокон поперечно-полосатой мышцы, следует информация, направляющаяся через задний корешок в различные отделы центральной нервной системы.
Все эти данные послужили основанием для развития представления о собственных рефлексах мышцы, о стрэч-рефлексах. В последующем, с учетом данных о рецепторах сухожилий, периартикулярных и артикулярных тканей, возникло учение об артрогенных мышечно-тонических реакциях и контрактурах. Взгляды эти были широко использованы в клинике (Charcot J., 1886; Vulpian А., 1886; Корнилов А. А., 1895; Даркшевич Л.О., 1907; Вельяминов М.Я., 1924; Илютович Г.Е., 1951; Емельянов Л.Н., 1958; Лауцевичус Л.З., 1950, 1967, 1971 и др.).
После того, как P.Hoffman (1922) описал собственный рефлекс мышцы, это учение в 40-е годы обогатилось важными данными. Оказалось, что до сокращения мышцы, т.е. до механических воздействий на веретено, последнее получает по тонким волокнам — у-эфферентам L.Lexel (1945) — предварительную информацию о предстоящем сокращении. Опережая импульс, следующий по толстым волокнам переднего корешка к нервно-мышечной пластинке, к веретену «спешат» импульсы-курьеры, импульсы-предвестники. Когда же мышца сократилась, сигнал из афферентных окончаний веретена поступает в центр, неся информацию об этом.
Мнение о том, что ct-малые нейроны заканчиваются на красных мышечных волокнах, а сс-большие — на белых, фазических, оспаривается рядом авторов (Юсевич Ю.С., 1958 и др.). Если состояние у-эфферентов — важный периферический фактор формирования рефлекса на растяжение и рефлекторного тонуса, состояние а-малых нейронов — центральный фактор мышечного тонуса.
Серое вещество спинного мозга содержит большое количество поперечно расположенных аксонов афферентных и эфферентных волокон и их коллатералей, объединяющих как одноименные ядерные образования, так и другие группы нейронов. Именно эти структуры играют значительную роль в распространении процессов возбуждения и торможения по всему спинному мозгу (Микеладзе А.Л., 1965). Обнаружено небольшое число афферентных волокон, вступающих через передние корешки, которые оказались симпатическими.
Проприоспинальные связи обеих сторон поясничного и шейного утолщений осуществляются не только комиссуральными клетками 8 пластины Рекседа, но и клетками с длинными аксонами (Shimamura M., 1973). Описанные выше прямые и обратные связи мышцы обеспечивают не только проприоцептивную глубокую и другие сложные виды чувствительности, но и ряд рефлекторных процессов с участием разных уровней: сегментарных, ствола мозга, мозжечка, больших полушарий. Уже центральные нейроны первого порядка представляют собой своеобразные усилители афферентного потока — они генерируют разряды большей частоты и длительности, чем исходные (Костюк П.Г., I960 и др.). Благодаря их «спонтанной» активности, особенно в условиях благоприятствующих супраспинальных полисинаптических влияний, кратковременная афферентнаяимпульсация, поступающая из мышцы, способна вызвать не только фазический, но и длительный тонический центральный эффект. Этому, естественно, будут препятствовать как супраспинальное полисинаптическое торможение, так и торможение в первых звеньях тормозного устройства (Schmidt R., 1969; Сафьян В.И., 1976). Супраспинальные нисходящие тонические импульсы поступают по медленно проводящим кортико-руброспинальным волокнам, по ретикуло- и вестибулоспинальным путям.
Когда прекращаются облегчающие влияния из ретикулярной формации ствола и ослабевают рефлексы на растяжение, наступает атония спинального центра (Сорох-тин Т.Н., 1961). С прекращением же угнетающих влияний на эти рефлексы последние усиливаются, и тонус нарастает. Это происходит как за счет импульсов а-малых клеток, так и веретена: чертик из табакерки выскакивает не только потому, что снята крышка, но и потому, что действует внутренняя пружинка.
Изменения тонуса протекают различно в мышцах преимущественно белых и преимущественно красных.
Существование двух типов мышц известно со времени L.Ranvier (1880). Одиночное сокращение в красной мышце продолжается в течение 100-120 мс, тогда как в белой — 20-60 мс. Сокращение в красных мышцах в энергетическом отношении экономичнее, чем в белых.
У амфибий такое деление весьма обоснованно: существуют красные волокна, специализированные на медленной тонической деятельности, и белые волокна, специализированные на фазной деятельности. У человека такое деление имеет значение относительное.

При его рождении все волокна медленные. Дифференциация начинается в первые недели жизни. У взрослого можно говорить о преобладании преимущественно белых мышц и о наличии отдельных красных, например камбаловидных, и смешанных. Красный цвет обусловлен миоглобином, кровью сети капилляров и митохондриями, повышающими оптическую плотность. В такой мышце ритмическая стимуляция вызывает локальную деполяризацию — развиваются медленные напряжение и расслабление. Малые низкопороговые мотонейроны, иннервирующие медленные мышцы, работают уже при небольшом возбуждающем влиянии. Они способны к длительной ацетилхолиновой контрактуре (Kuffer S. et al, 1953; Сагдеев СБ., 1971) и обеспечивают слабое, но малоутомительное сокращение. В белой мышце даже одиночный импульс вызывает распространяющийся потенциал действия и сокращение. Для ее неэкономных волокон требуется большая частота раздражения. S.Cooper, J.Eccles (1930) установили в экспериментах на кошках, что при ритмической стимуляции слияние сокращений для камбаловидной мышцы составляет 30 импульсов в секунду, а для икроножной — 100. Согласно H.Henneman, C.Olson (1965), частоты раздражения, при которых наступает максимальное напряжение, т.е. гладкий тетанус, в медленной и быстрой мышце соответственно составляют 5-10 и 150 Гц. Я.М.Коц (1972) рекомендует определять характер мышцы человека (медленная или быстрая) с помощью слабого тетанического электрического раздражения. Время от начала движения до момента достижения максимальной амплитуды, т.е. период восходящей части кривой сокращения, равно как и время полурасслабления, указывает на «медлительность» или «быстроту» мышцы. Разделение мышечных волокон на 3 типа: А, В и С основывается на результатах исследований H.A.Padykula и его сотрудников (1958, 1962). Такое разделение удалось благодаря окраске волокон на гликоген, АТФ-азу, неспецифическую эстеразу и, в особенности, на сукцинатдегидрогеназу (СДГ). В темном спектре волокон красных мышц преобладает аэробный гликолиз, метаболизм, зависящий от кислорода, при низкой способности расщеплять гликоген и высоком липидном обмене. В светлом спектре волокон в белых мышцах преобладает анаэробный гликолиз. В медленной мышце весьма высока вязкость. Это препятствует проявлению силы при больших скоростях сокращения. Соответствующая кривая сила-скорость (Ward А., 1938; Wells J., 1965) показывает, что в такой мышце с нарастанием скорости сокращения сила падает значительнее, чем в быстрой мышце.
Схематические различия красных и белых мышц представлены в табл. 3.1.
Кроме фазных, в мышце имеются и тонические волокна. Иннервация красных мышц осуществляется тонкими нервными волокнами, что было установлено еще в 1901 г. (Hay J.). Значительно позже, когда была проведена рубрификация и нервных волокон — А, В, С (ErlangerJ., Gasser H., 1937), выяснилось, что красные мышечные волокна иннервируются а-малыми нервными волокнами (Eccles J., 1937, 1957). Чем толще нервное волокно, т.е. чем больше скорость проведения импульсов, тем больше скорость сокращения соответствующей мышцы (Bessou P. et al., 1963).
В а-малых нейронах, согласно D.Kernell (1966), больше общее сопротивление мембраны. Это означает, что под действием одних и тех же токов в них тоническая возбудимость больше, чем в крупных нейронах. У красных мышц, например камбаловидной, более низкий порог рефлекса на растяжение, чем у белых, т.е. у них более низкий порог на раздражение веретен. У спинальных животных активация мотонейронов медленных мышц вызывается легче, чем активация быстрых. Она происходит даже при раздражении аффе-рентов соседних мышц (Eccles J., Eccles R., 1957). Удецеребрированного животного красная камбаловидная мышца в ответ на растяжение дает напряжение, равное 90% своей максимальной тетанической активности, а икроножная — лишь 10% (Denny-Brown D., 1929).
Известно, что в скелетной мышце имеются не только рабочие экстрафузальные волокна, обеспечивающие движение и позу, но и интрафузальные волокна веретен, управляющие частотой их импульсного разряда. Эти последние, считавшиеся медленными, тоже оказались неоднородными: они бывают быстрыми и медленными (Smith К., 1966; Diete-Spiff К., 1967). Механическая реакция на небольшое напряжение быстрого интрафузального волокна млекопитающего сводится к значительному противодействию, а реакция медленного волокна выражается в смещении и медленном
восстановлении длины. Речь идет о поведении веретена с эластической сумкой, соединенной последовательно с весьма вязкой средой. Также и на тетаническое электрическое раздражение медленное интрафузальное волокно отвечает сокращением и расслаблением более медленным, чем быстрое интрафузальное. В веретенах выявляются и волокна с ядерной сумкой (ЯС) и с ядерной цепочкой (ЯЦ). Они различаются по длине лишь в крупных мышцах конечностей: около 7,5 мм в ЯС- и около 4 мм в ЯЦ-волокнах. После деафферентации ЯЦ-мышечные волокна веретен атрофируются, причем совершенно так же, как обычные экстрафузальные волокна. Следовательно, эти элементы рецепторов обладают и моторной иннервацией, которой не обладают никакие другие типы рецепторов.
Что касается моторной иннервации медленных и быстрых интрафузальных волокон, то еще Cipollone (1897-1898) утверждал, что сокращение интрафузальных мышечных волокон происходит под влиянием идущих к ним нервных импульсов, а не внешнего давления на капсулу. Вследствие же сокращения интрафузальных мышечных волокон, располагающихся в полярных частях веретен, последние и приходят в состояние возбуждения. Автор наблюдал дегенерацию тонких миелиновых волокон, направляющихся в составе передних корешков к интрафузальным мышечным волокнам. Здесь они заканчиваются кустовидно или концевыми пластинками. Особенностью расположения нервных волокон в икроножной мышце является малокалиберность и рассеянность пучков (Абдуллаев М.С., 1960). Камбаловидная мышца богата кислыми митохондриальными ферментами, сукцинатдегидрогеназой, а икроножная — фосфорилазой. При блокировании нервно-мышечной передачи трехглавой мышцы голени сублетальными дозами ботулинического токсина камбаловидная мышца оправляется от пареза быстрее, чем икроножная. В последней гистологические изменения в нервно-мышечных окончаниях остаются на несколько месяцев. Она надолго лишается окраски на фосфорилазу, тогда как камбаловидная реагирует на первых порах даже быстрее, чем в норме (Duchen L., 1970). Импульсы у-волокон предшествуют двигательным импульсам а-толстых волокон. Классические эксперименты L.Lexel (1945) показали, что такое раздражение тонких миелиновых у-волокон и сокращение интрафузальных волокон вызывает разряд в задних корешках. R.Granit (1973) допускает, что медленно нарастающее интрафузальное сокращение связано с активацией у-кустовидных окончаний. Мышечные веретена являются сенсомоторными регуляторами, и эта реакция, видимо, осуществляется дифференцированно через медленные и быстрые волокна.
Каким образом под влиянием нервных импульсов в самой мышце реализуется процесс сокращения?
Как следует из приведенной выше функциональной модели скелетной мышцы, ее соединительнотканные структуры находятся в состоянии определенного растяжения, внутримышечного давления. С приходом нервного импульса к имеющемуся напряжению прибавляется механическое напряжение в зависимости от количества преобразованной биохимической энергии в механическую.
Известны три формы мышечного сокращения: 1) изометрическая, когда мышца сохраняет свою длину; 2) концентрическая или миометрическая, изотоническая, с укорочением, выполнением положительной работы, в условиях, когда внешняя нагрузка меньше напряжения мышцы; 3) эксцентрическая или плиометрическая, когда мышца удлиняется, т.е. выполняется отрицательная работа, внешняя нагрузка больше напряжения мышцы, при этом чем больше вытянута мышца, тем менее она удлиняется при увеличении груза. Чаще имеет место смешанная форма — ауксотоническая, причем фаза напряжения короче фазы расслабления приблизительно вдвое. Демпфирование (глушение за счет потери энергии) выражено резко в сократительных элементах и слабо—в пассивно упругих. Что касается прочности связок и сухожилий, то она зависит от скорости их растягивания: чем выше эта скорость, тем больше нагрузка, требуемая для их разрыва. При растягивании целой мышцы наибольшее сопротивление оказывают соединительнотканные элементы.
Эти механизмы срабатывают при повышении тонуса всей мышцы. Они важны для понимания преходящего и устойчивого гипертонуса, контрактуры и отдельных участков мышцы.
На первых порах представления о мышечных уплотнениях складывались в понятиях коллоидной химии. Позднее стадии затвердения понимались как изменения коллоидов мышечного белка, переход от золя к гелю с консистенцией отвердевшего студня (миогелоз Schade Н., 1920; Lange М., 1931). Хотя оба автора описали эти образования независимо друг от друга, они дали общую оценку обнаруженным зонам мышечной резистентности. С помощью специального склерометра Н.Schade установил, что в норме различные мышцы отличаются по степени их плотности не более чем на 10%, тогда как в зонах миогелоза — до 50%. Уплотнения оставались и после новокаинизации и даже после смерти больных, отчетливо пальпируясь до наступления трупного окоченения. М.Lange пытался воспроизводить миогелозы в эксперименте путем стимуляции мышц бедра кролика и при местном замораживании. H.Strauss (1928) вслед за Гольдшейдером считал, что изменения эти связаны с холодом косвенно: холод вызывает вазомоторные сдвиги, анемию, затем венозный стаз. A.Schmidt (1910) определял в пораженных кусочках мышц повышенное кровенаполнение. Вследствие этого меняется и химизм мышцы. В ней накапливаются недоокисленные продукты, отмечается ацидоз (Good M., 1941, 1958), повышается содержание сукцинатде-гидрогеназы (Веселовский В. П., 1978; Хабиров Ф.А., 1991), повышается содержание хлоридов с относительным снижением содержания калия (Brendstrup Я. etai, 1957), накапливаются кинины (Kellenneyer F., 1968).
В условиях гипоксии происходит раздражение тучных клеток соединительной ткани, усиливается выделение ими гистамина и, следовательно, повышается проницаемость капилляров. Перицеллюлярные пространства увеличиваются. Тучные клетки выделяют гепарин, нейтрализующий гиалуронидазу, — накапливаются гиалуроновые кислоты (Drennan Y., 1951).
Видимо, существуют различные стадии развития и в самой группе «миогелозов». Нам приходилось наблюдать их переход в плотные образования бугристой консистенции, не поддающиеся разминанию. В таких случаях, наоборот, боли после массажа усиливались, что вполне понятно при обызвествлении очага миогелоза. Возможность перехода миогелоза в оссифицирующий миозит, как нам представляется, говорит в пользу того, что введение гипертонического раствора (видимо, не только натрия, но и кальция) патологически видоизменяет мышцу, нарушает состояние ее рецепторов и создает в ней триггерные зоны (см. ниже данные об экспериментальном формировании склеротомных болей).

Рис. 3.18. Биоптаты из зон болезненного уплотнения, окраска гематоксилин-эозином: а — лестничная мышца, увеличение количества мышечных ядер (1), расщепление на отдельные диски (2); б и в — икроножная мышца больного остеохондрозом: 1 — участки фиброза перимизия; 2 — жировое замещение; 3 — группы и одиночные атрофированные волокна; 4 — участки воспаления вокруг некротизированных волокон; 5 — группа атрофированных волокон на площади целого фасцикула; 6 — дефицит волокон II типа.
Миофиброз, возникающий по тем же причинам, является наиболее частым вариантом завершающей стадии развития дистрофического процесса. Умеренная болезненность возникает при растяжении и меньше — при пальпации мышцы. Прощупываются плотные тяжи продолговатой формы. Тяжистость определяется во всей толще мышцы. Активное расслабление затруднено. Т.к. снижается эластичность, в отдельных случаях несколько ограничивается объем движений. Атрофии и снижения силы нет, т.к. необратимые изменения в одних фибриллах компенсируются гипертрофией других. Возможно осложнение надрывом мышц. В отличие от периартрозов, болезненность тканей незначительна, она возникает не при всех движениях в суставе.
При миогелозах M.Lange (I931) находил разрастание соединительной ткани, дегенерацию и разрежение мышечной.
G.Glogowski, J.Wollraff(1951) проводили биопсию у 20 больных с миогелозами и выявили восковидную дегенерацию мышечных волокон, их деструкцию, увеличение количества ядер, скопления их, жировую инфильтрацию. Авторы утверждали, что это определенная клинико-морфологическая форма. Различные результаты морфологических исследований определяются, по-видимому, не только выбором участка мышцы для биопсии, не только методикой исследования, но и стадией развития мышечных изменений.
В нашей клинике были подвергнуты гистологическому исследованию кусочки девяти передних лестничных мышц больных со скаленус-синдромом. Парафиновые срезы окрашивали гематоксилин-эозином и по ван Гизону (Кипер-вас И.П., Зайцева О.Л., 1967). При пальпации эти мышцы были плотны, болезненны и увеличены. Это подтверждалось и на операционном столе. Как показало гистологическое исследование, среди нормальной мышечной ткани имелись мышечные пучки неравномерной толщины и окраски. Часть их была гипертрофирована, часть — атрофична. Некоторые волокна были набухшими, гомогенными, без поперечной исчерченности, иногда со стертым фибриллярным строением. В ряде волокон, наоборот, миофибриллы были видны отчетливо, но расщеплены по длине с образованием узких щелей между отдельными пучками их. Встречались и волокна с явлениями очагового миолиза, глыбчатого и зернистого распада. В некоторых волокнах определялось поперечное расщепление на отдельные диски с увеличением количества мышечных ядер, в некоторых — вакуольная дистрофия.
В участках измененных мышечных волокон соединительная ткань была разрыхлена, отечна, иногда с увеличением количества клеточных элементов и коллагеновых волокон, местами с переходом в фиброз и склероз. В таких участках мышечные волокна были раздвинуты. Соединительная ткань, богатая клеточными элементами, гистиоцитами, фибробластами и лимфоидными элементами, иногда имела рубцовый вид. В некоторых сосудах эндотелий был набухший, иногда пролиферирующий. Отмечалось утолщение стенок сосудов. В мышечных волокнах этих участков обнаруживались выраженные явления атрофии и дистрофии, в некоторых из них встречались многочисленные ядра и клетки (рис. 3.18). Подобные изменения были описаны затем и H.Tichy, K.Seidel (1969). Таким образом, вторая (органическая) стадия мышечно-болевого синдрома связана с различными дистрофическими изменениями: зернистый и глыбчатый распад, очаговый миолиз, дисковидный распад мышечных волокон, вакуольная дистрофия и пр., с переходом в фиброз и склероз. Биопсийный материал, взятый из болезненных мышечных уплотнений икроножной мышцы у 23 больных вертеброгенной люмбоишиальгией, также показал, что вслед за серозным пропитыванием наступают продуктивно-пролиферативные изменения. Обнаруживались группы одиночных атрофированных мышечных волокон, волокна-мишени, фиброз эндомизия, а в поздних стадиях — более грубый фиброз (Попелянский Я.Ю., Хаби-ровФ.А., 1993). Укороченная мышца теряет уровень диффе-ренцировки, происходит сдвиг в составе «медленных» и «быстрых» волокон (рис. 3.19).
J.Travell и D.Simons (1983) считают укорочение специфическим фактором активации курковых зон мышцы: длительное укорочение, например во сне, или внезапное, например при расслаблении укороченного агониста хлорэтилом.

Ограничение функции характерно как для активного, так и для латентного пунктов, спонтанная же боль — только для первого.
Белки мышечно-сухожильной ткани и болезненных мышечных узелков — зон нейроостеофиброза становятся аутоантигенами (Tichy Н., Seidel К., 1985; Попелянский Я.Ю., Веселовская О.И., 1985).
Перед тем как указать на малотравматические современные методики оценки состояния мышц при болевых синдромах, соответствующие данные целесообразно сопоставить с результатами экспериментальных исследований на животных.
С.С.Вайль (1967) вызвал перенапряжение мышц, вынуждая крыс плавать до изнеможения. При окраске мышц этих животных гематоксилин-эозином в поляризованном свете мышечные волокна определялись слегка извилистыми, саркоплазма образовывала горбовидные выбухания. В соответствующих участках анизотропные диски сливались, образуя сплошные двояколучепреломляющие фрагменты, что, по мнению автора, соответствует выраженным контрактурам. Подобные изменения находил наш сотрудник В.П.Веселовский после такого же типа перенапряжения мышц у подопытных животных. Другой группе крыс в латеральную головку икроножной мышцы вводилось 0,5 мл 10% раствора хлористого кальция. На втором месяце опыта в толще икроножной мышцы, чаще в месте начала обеих головок, выявлялась болезненность — животные реагировали на их пальпацию более бурно, чем на пальпацию других зон. Начиная с четвертого месяца, в медиальной головке мышцы обнаруживались постоянные участки уплотнения, и на той же конечности определялась кожная гипотермия. Здесь же на электромиограмме регистрировалось удлинение периода «успокоения» в ответ на погружение игольчатого электрода в мышцу. Выявлялась также нейрогуморальная декомпенсация в системе ацетилхолин-холинэстераза (гиперацетилхолинемия при снижении активности холинэстеразы), увеличивалась активность окислительно-восстановительных ферментов, лактатдегидрогеназы и сукцинатдегидрогеназы, снижалась активность ДПН-диафоразы (коэнзимы I и II, динуклеатиды фосфатные). Нарушения в указанных системах находились в прямой зависимости от выраженности уплотнений в мышцах.
В свете изложенного представляют интерес результаты исследований наших учеников по изучению обсуждаемой патологии мышц. В альгической фазе, когда объективные симптомы ограничиваются почти исключительно местными изменениями тонуса мышцы, интересные показатели нередко дает игольчатая электромиография. Обнаруживаются усиление и удлинение периода биоэлектрической активности погружения и усиление активности покоя. Появляется залпообразная активность покоя в ограниченных участках гипертонуса. В этот же период улавливаются и сдвиги тканевого клиренса (процента снижения радиоактивности в минуту) при введении изотопа в пораженную мышцу (Алябина Н.Е., Заславский Е.С., Ходич Т.Г. и соавш., 1973).
Что касается нейродистрофических влияний на мышцу и соединительную ткань, то на первых порах предполагалось, что они адресуются к сосудистому аппарату и реализуются через вазомоторику (Сеченов И.М., 1866; Бехтерев М., 1925; Brunning L., 1952). Одновременно на разных этапах изучения нейротрофики накапливались факты в пользу непосредственных нервнотрофических влияний.
В лаборатории С.П.Боткина его сотрудники С.В.Левашов (1880), а затем И.П.Павлов (1882,1883) наблюдали усиление функциональной активности стенки сосудов задней лапы и сердечной мышцы собаки при раздражении определенных нервов. Это в последующем (1892) позволило И.П.Павлову поддержать представление S.Magandie (1834), Samuel'a (1860) о наличии специальных трофических нервов. Эту рефлекторную функцию стали приписывать всей вегетативной или только симпатической (Орбели Л.А., 1938), или соматической нервной системе. В последнем случае одни авторы отдавали преимущество чувствительной (Wybum-Mason R., 1950; Грацианская A.M., 1956; Григорьева Т.А., 1959; Лебединский А.В., Нахильницкая З.Н., 1964), другие — двигательной иннервации (Gutman Е. et al, 1956, 1962; Гник П., 1958; Hollos G. et al., 1960; Felix W., 1962). Л.А.Орбели (1938) говорил о тономоторной функции симпатикуса, создающей почву для действий соматических тономоторных нервов. М.Р.Могендович отождествляет эту концепцию с представлением R.Granit (1957) о у-эфферентах.
В настоящее время большинство авторов признает, что трофическая функция осуществляется всей нервной системой, а нарушение трофики может возникнуть при повреждении любого ее отдела (Сперанский А.Д., 1936, 1952; Баяндуров Б. И., 1949; Коштоянц Х.С, 1951; Боровский М.Л., 1952, 1957; Зайко Н.Н., 1954; Бентелев A.M., Надежкин Л.В., 1959; Волкова О.В., 1970; Швалев В.К, 1971). Прямые трофические влияния дополняются влиянием симпатикуса на сосуды, питающие ткань через адренергические волокна (Говырин В.Н., 1967).
Эти общие теоретические представления о нейродистрофии позволили глубже оценить новые факты, полученные благодаря внедрению внутриклеточной регистрации электрических потенциалов, гистохимического и электронно-микроскопического методов, осмыслить изменения в клетках на молекулярном и субклеточном уровнях. Общие синтетического характера концепции не препятствовали выяснению интимных механизмов реализации трофических функций. В частности, продолжается раздельное изучение возбуждающего действия нерва, т.е. приводящего к мышечному сокращению, и трофического
Независимость трофического влияния нерва на мышцу от возбуждающих двигательных импульсов установлена в опытах инактивации мышц с помощью тенотомии, а также фиксации суставов (Chor Н., Dolkart R., 1936; Katpati G., 1968), изолирования отдела спинного мозга (Towwer, 1937), новокаиновых блокад нервного ствола (Gutmann E., 1962).
Электронно-микроскопические исследования показали уменьшение диаметра мышечных миофибрилл при всех видах атрофии (Wechsler W., 1966). Как в денервированной, так и в тенотомированной мышце, кроме того, снижается активность фосфорилирования из-за замедления ферментативно-фосфорилазной и фосфогексокиназной деятельности (Телепиева В.И., 1955). Нейрогенный вариант атрофии отличается от атрофии при инактивации большим темпом потери веса и более быстрым уменьшением диаметра мышечных волокон (Muscatello V., Patriarca P., 1968); наблюдается более резкое падение концентрации карнозина и креатина и более значительное увеличение содержания глутаминовой кислоты, чем при тенотомии (Юдаев НА. и др., 1953). Свободные Н-группы, появляющиеся в дегенерированной мышце, содержатся в меньшем количестве в тенотомированной (Попова М.Ф., 1956). Существенные различия обнаружены в содержании нуклеиновых кислот: значительное повышение уровня ДНК, отмечаемое в денервированной мышце, не происходит при тенотомии, что связывают с различиями в числе мышечных ядер (Hollos J. et al., 1960; Gutmann К, 1961, 1962). Содержание РНК в первые дни понижается больше в денервированной мышце, чем в тенотомированной (Hobos G. etal., 1960). Специфическим для денервированной мышцы является повышение ее чувствительности к медиаторам, особенно к ацетилхолину (Кеннон У., Розенблют Б., 1951), снижение уровня дыхания (Никитин В.Н. и др., 1956), повышение содержания воды, что не наблюдается в тенотомированных мышцах.
Регулярная электростимуляция обездвиженных мышц предохраняет их от атрофии и поддерживает нормальную мышечную силу (Кеннон У., Розенблют А., 1951). Электротерапия денервированных мышц задерживает атрофию на определенный период времени, сила сокращения при этом уменьшается, повышается чувствительность к ацетилхолину (Гинецинский А.Г., 1956), содержание ДНК не меняется (Gutmann Z, 1961). Авторы оценивают это как доказательство наличия специфического трофического влияния нерва.
Стало ясно, что нервная система регулирует метаболизм мышцы, воздействует на анаболические процессы. Трофическая функция нерва заключается в усилении послефункциональных восстановительных процессов. Об этом можно судить по тому, что в денервированной мышце после ее раздражения не усиливается процесс ресинтеза гликогена, не повышается синтез белков, не наблюдается усиления утилизации безбелкового азота и повышения потребления кислорода, как это происходит после раздражения нормальной мышцы.
Согласно гипотезе Е.Gutmann (1961), трофическое влияние нерва осуществляется путем транспортировки с током аксоплазмы определенного вещества, вырабатываемого нейроном.
Р.П.Женевская (1974) изучала пластические процессы мышечной ткани в условиях регенерации нерва в период до начала сократительной реакции мышцы в ответ на раздражение нерва. Установив факт трофического влияния нервана денервированную мышцу в тот период, когда в процессе регенерации еще не сформирован мионевральный синапс, автор приходит к следующему заключению: нерв в данных условиях, когда невозможна передача возбуждающего импульса (еще отсутствует мионевральный синапс), не функционирует как компонент нервной системы. Следовательно, обнаруженное трофическое влияние осуществляется самой тканью двигательного нерва.
При оценке результатов собственных экспериментов автор вслед за другими подтвердила, что трофическое влияние нервной системы заключается в передаче иннервируемым тканям нервно-трофических метаболитов, действующих по типу веществ, осуществляющих эмбриональную индукцию.
Обнаруженный исследователем факт задержки роста аутотрансплантатов и реиннервированных мышц в отсутствии проприоцепции дает основание считать, что подача нервно-трофических метаболитов мотонейронам контролируется системой обратных связей по афферентным путям, возможно, также с помощью передачи специфических веществ от мышечной ткани. Сейчас уже известно, что движение веществ по нерву осуществляется в обоих направлениях: обнаружен ток веществ не только от тела нейрона к периферии, но и от иннервируемой ткани к телу нейрона по микротрубочкам (Weiss J., 1969). Эти сведения связаны с довольно детально разработанным учением об аксоплазматическом токе.
Таким образом, существуют данные о роли афферентных путей из мышцы, обратных связей, регулирующих подачу нервно-трофических метаболитов мотонейронам.
В свете всего изложенного выше состояние кровоснабжения мышцы, ее обеспеченность кислородом приобретают новое значение. Отмеченная стадийность мышечно-трофических и нейродистрофических процессов заставляет нас вспомнить о стадийности сосудистых сдвигов в тех же тканях.
Известно, что первыми при ишемии страдают нервно-мышечные аппараты (Ходос Х.Г., 1940) при одновременной высокой чувствительности и сосудистых рецепторов к кислородному голоданию (Долго-Сабуров Б.А., 1956; Куприянов В.В., 1955 и др.).
Некоторые сведения о нейродистрофических сдвигах в условиях ишемизации тканей дали следующие эксперименты.
С.С.Трач и А.Р.Радзиевский (1970) перерезали артериальные магистрали и вводили в мышцы АТФ. При этом возникавшие атрофии были значительно меньше, чем при перерезке сосудов без введения АТФ. То же касалось и изменений в нервных структурах. Если без введения АТФ ишемизация ведет к распаду нервных окончаний вплоть до их фрагментирования, при введении АТФ грубых реактивно-дистрофических нарушений не было. Отмечались лишь реактивно-регенеративные изменения: вздутия и утолщения нервно-мышечных пластинок и разрастания шванновских структур. В саркоплазме вблизи нервно-мышечной пластинки уменьшалось количество митохондрий. Т.к. АТФ эффективен при введении его в ничтожно малых дозах, он действует на мышцу не непосредственно, а через нервно-мышечные приборы. В этой связи следует помнить основополагающие данные В.А.Энгельгарта (1939): миозин разлагается АТФ, а последняя и ее ферменты делают миозиновые волокна более растяжимыми.
Как ни велика роль гипоксии в описанных дистрофических процессах в мышечных и фиброзных тканях, влияния ее самой по себе недостаточно для объяснения нейромио-и нейроостеофиброза. В поисках других механизмов этих процессов было обращено внимание на то, что они развертываются: а) не только в связи с микротравматизацией (роль статико-динамических перегрузок при остеохондрозе); б) не только в связи с вазомоторными нарушениями; в) не только в связи с эфферентными импульсами, следующими по поврежденному корешку (роль компрессионных механизмов остеохондроза); г) не только в связи с эфферентными импульсами, следующими по здоровым нервным стволам из зон ирритации позвоночника и соответствующего квадранта тела (роль рефлекторных механизмов остеохондроза).
Было установлено, что тонические и нейродистрофические нарушения в мышечно-фиброзных тканях возникают нередко под влиянием ряда экзогенных факторов, обусловливающих аутоиммунизацию. Антигенные свойства, «чуже-родность» могут приобрести не только ткани, формировавшиеся изолированно от лимфоидной системы, как, например, выпавшие пульпозные ядра межпозвонковых дисков, но также, при определенных условиях, денатурированные белки любых тканей, в том числе мышечных и фиброзных периферических нервов.
Рассмотрение нейродистрофических изменений мышц невозможно без одновременного анализа соответствующих изменений их соединительнотканных элементов и соединительной ткани вообще. Миофиброз и нейроостеофиброз — это в такой степени связанные звенья одной патологической цепи, что можно считать целесообразным включение в понятие нейроостеофиброза и явления миофиброза. Не удивительно, что и другие терминологические попытки совершаются в направлении подобных же обобщений — например, миоэнтезиты... Перед тем как рассмотреть различные стороны патогенеза не только мышечно-тонических, но и миофиброзных дистрофических процессов и, в частности, их аутоиммунных механизмов, остановимся на некоторых особенностях соединительной ткани вообще.
И.И.Мечников (1892) высказал важные взгляды о роли клеток соединительной ткани в формировании иммунитета. Эти идеи получили дальнейшее развитие в трудах А.А. Богомольца (1936) о системе соединительной ткани. Она несет опорно-трофическую функцию, состоит из клеток, межклеточного аморфного вещества и волокнистых структур. Новообразование основного вещества соединительной ткани и ее коллагеновых волокон связано с жизнедеятельностью фибробластов. Биохимики установили сложную структуру главнейшего белка ткани волокнистых структур — коллагена. Гистохимия позволила более углубленно изучить группу коллагеновых заболеваний.
J.Nageott (1927, 1931), учитывая данные Эвальда о растворимости коллагена в слабокислой среде, а также способность его выпадать из раствора в форме фибрилл под влиянием солей, выдвинул биохимическую гипотезу образования коллагена. Согласно этой гипотезе, растворимый коллаген образуется из некоего белка крови, а затем осаждается под влиянием солей в коллаген. Гистологи разделяют данную концепцию, подчеркивая, что коллаген образуется из лреколлагена. Обе точки зрения примиряет А.А.Тустановский (I960), установивший, что растворимый коллаген является биохимическим предшественником коллагена,и этот предшественник они совместно с В.И.Ореховичем (1952) назвали проколлагеном (не путать с преколлагеном биохимиков). Т.к. в фибриллогенезе участвуют коллагеновые и неколлагеновые белки и мукополисахариды, коллаген рассматривают и как белково-мукополисахаридный комплекс (Jackson D. et ai, 1958). Морфологи, установив, что в коллагеногенезе первым этапом бывает преколлаген, своими методами не могли решить, пропитывается ли коллаген растворимым коллагеном или, деградируя, замещается вторым, или превращается в него биохимически. По точному замечанию АА.Тустановского, «...биохимики не изучали того, что видели морфологи, а морфологи не видели того, что предлагали видеть биохимики» (1960, с. 8). Г.В.Орловская и АЛ.Зайдес (1956) показали, что аргирофильный преколлаген эмбриональной закладки, не обладая рентгеноструктурными особенностями коллагена, со временем приобретает их. Оказалось, что белковая основа коллагена — комбинация двух белковых компонентов, один из которых — про-коллаген, другой — колластромин, который генетически связан с проколлагеном морфологов. Проколлаген и колластромин взаимодействуют по типу сочетания двух фаз: наружная фаза образована слоями проколлагена, внутренняя — нитями колластромина. В последних в дефинитивном коллагене сохраняется преколлаген как начальная фаза. Наименьшая структура единиц, содержащая обе фазы, — первичная коллагеновая фибрилла диаметром 500-1000 А. Эта единица одновременно морфологическая (на электронном уровне) и биохимическая. Каждая фаза содержит полисахариды, а колластроминовая — еще и глобулярные белки. Она занимает 80% свежего веса коллагена. Коллаген не идентичен волокну, он первичная коллагеновая фибрилла, элемент коллагенового волокна, но уже является многофазной и многокомпонентной системой (Зай-десА.Л., 1960). Образование компонентов коллагена, способы их сочетания остаются в области биохимии. Образование же коллагенового волокна — область фибриллогенеза. Коллагенообразование — стадия волокнообразования. Эластичные волокна также состоят из коллагеновых, только очень тонких, фибрилл. В них также имеются мукополисахариды. Кроме того, из них выделен белок эластин.
Применительно к остеохондрозу важно, что образование коллагена нарушается при С-авитаминозе. McCormick (1954) подчеркивает, что при этом нарушается синтез коллагена в тканях диска, т.е. наступает дистрофия фиброзного кольца. Потребление оптимального количества витамина С является фактором сохранения целостности межпозвонкового диска (Greenwood J., 1964). В.Б.Киселев (1971) у больных остеохондрозом выявил С-витаминную недостаточность, характерную для них во все сезоны года. Недостаток аскорбиновой кислоты влияет на выработку проколлагена (Орехович В.Н., 1952) и полисахаридов, участвующих в его формировании.
Важными для регуляции коллагенообразования и других функций соединительной ткани являются гормональные факторы, в первую очередь состояние системы гипофиз — кора надпочечников. Введение АКТГ, глюкокортикоидов, гормона щитовидной железы угнетает размножение фибробластов, задерживает развитие грануляционной ткани. Противоположное действие оказывает соматотропный гормон. Тестостерон стимулирует образование основного вещества и способствует аккумуляции в нем серы.
В старости известны атрофические изменения коллагеновых волокон при увеличении эластина, в частности в коже. В основном веществе соединительной ткани количество кислых мукополисахаридов уменьшается, накапливаются мукопротеиды, нарушаются процессы диффузии и ухудшается питание клеток, прогрессируют дистрофические процессы. Такие изменения А.В.Мельченко и соавт. (1965) отмечали и в дистрофичных межпозвонковых дисках.
В патологических условиях при бесклеточных склерозах (Абрикосов А.И., Струков А. И., 1953, 1954) вместо оформленных преколлагеновых волокон образуются аргирофиль-ные белково-полисахаридные массы, на которых неупорядоченно откладывается проколлаген. При разрастании соединительной ткани с участием клеток преколлагеновые аргирофильные волокна претерпевают преобразование по эмбриональному типу. При коллагеновых болезнях наблюдается дезорганизация коллагеновых волокон.
Под разрешающим воздействием экзогенных факторов сами по себе денатурированные белки соединительной ткани могут стать внутренним источником реактивных, в частности, аутоиммунных процессов. Аллергический же фактор, как показали О.Я.Острый и З.И.Собиева (1961), А.И.Зайко (1970) и др., является одним из компонентов неврогенной дистрофии. Другими словами, компонентом нейроостеофиброза являются и аутоиммунные реакции, включающиеся в нейрогенный дистрофический процесс при остеохондрозе. Этот процесс, таким образом, зависит и от особенностей взаимодействия аутоантигенов с соответствующими антителами.
А.Д.Адо (1970) классифицирует антитела по трем категориям: 1) агрессивные (с цитотоксическим повреждающим действием на клетки и ткани); 2) аутоантитела-свидетели (без агрессивных свойств), наличие которых выявляется серологическими реакциями и указывает на факт воздействия аутоантигенов; 3) защитные аутоантитела, способствующие выздоровлению организма от аутоиммунного заболевания и переходу аутосенсибилизации в состояние резистентности к данному тканевому раздражителю. Они также транспортируют к местам выделения и обезвреживают постоянно возникающие продукты распада клеток совершенно здорового организма.
Я.Ю.Попелянский
Ортопедическая неврология (вертеброневрология)
Подберём Вам бесплатно нужного врача-специалиста
Комментировать:
Похожие статьи:
Скорость проведения моторного импульса
Категории: Ортопедическая неврология, Анатомия и методики обследования,
Информативный показатель степени поражения мотонейрона. Метод основан на ЭМГ регистрации биоэлектрических ответов мышц при раздражении соответствующего нерва в проксимальном и дистальном отделах. Это..
Электромиография (ЭМГ)
Категории: Ортопедическая неврология, Анатомия и методики обследования,
Оценку результатов исследования с помощью поверхностных электродов наиболее целесообразно проводить по классификации Ю.С.Юсевич (1958). I тип электромиограмм: частые, выше 50 Гц, колебания потенциала,..
Кожная гиперестезия и гипоальгезия
Категории: Ортопедическая неврология, Анатомия и методики обследования,
Кожная гиперестезия встречается у больных остеохондрозом сравнительно редко. Определение ее границ и общая оценка затруднительны без специального инструментального исследования. Практическая значимость..
Определение болезненности других стандартных точек
Категории: Ортопедическая неврология, Анатомия и методики обследования,
Кроме болевых зон, более или менее индивидуальных для каждого больного, существует группа типичных «болевых точек». Они локализуются в конкретных зонах, которые врач должен проверить в определенной..
Определение болезненных мышечных узелков
Категории: Ортопедическая неврология, Анатомия и методики обследования,
При исследовании мышц в плане нейрорефлекторных дистрофических процессов для клинициста наибольший интерес представляют те местные мышечные спазмы и другие изменения, которые могут быть определены..
Фотометрические методы исследования
Категории: Ортопедическая неврология, Диагностика и лечение заболеваний,
Первыми фотографию лица, как способ диагностики аномалий развития зубочелюстной системы использовал Angle и его современники. Для того, чтобы фотографии можно было использовать для наблюдения за..
Временная нетрудоспособность
Категории: Ортопедическая неврология, Диагностика и лечение заболеваний,
Вопрос об экспертизе временной нетрудоспособности и целесообразности выписки больного на работу решается на основе общих принципов врачебно-трудовой экспертизы с учетом медицинских и социальных критериев...
Трудности экспертизы при вертеброгенных заболеваниях
Категории: Ортопедическая неврология, Диагностика и лечение заболеваний,
Экспертиза при вертеброгенных заболеваниях — это практически оценка того, в какой мере больной способен передвигаться, трудиться. В какой мере вопросы трудоспособности при поясничных, шейных или грудных..
Профилактика обострений в условиях производства
Категории: Ортопедическая неврология, Диагностика и лечение заболеваний,
В условиях промышленного и сельскохозяйственного производства профилактика и заболеваемость обнаруживают зависимость от следующих четырех факторов: система разработок, степень освоения проектных..
Профилактика обострений, противорецидивная терапия
Категории: Ортопедическая неврология, Диагностика и лечение заболеваний,
Корректные суждения о профилактике остеохондроза требуют учета полифакториальности заболевания, преимущественной роли наследственного предрасположения и в первую очередь статико-динамических перегрузок...