Учебные материалы
Полезное
Конектбиофарм
Работа
Компании
Механизмы регуляции остеогенеза
В стадии резистентности, при стрессе, травме, кровопотере и воспалении число стволовых клеток костной и хрящевой ткани (СККХ) в костном мозге достоверно возрастает (Дыгай, Шахов, 1989). При создании дефицита глюкокортикоидов, Т-лимфоцитов или блокаде системы мононуклеарных фагоцитов (СМФ), стимулирующая активность макрофагов на стволовые клетки костной и хрящевой ткани и ПКПКХ исчезает (Шахов, 1997; Shakhov et al., 1999). Если таким животным восстановить утраченную функцию, например, с помощью введения дексаметазона, то число костных прекурсоров вновь возрастает. Была высказана гипотеза, что данная закономерность подчиняется дрейфующему каскадоподобному механизму адаптации (ДКМА), которая последовательно включает ключевые гомеостатические системы макроорганизма от нервной к эндокринной, затем Т-клеточной, СМФ, кроветворной системам. Результатом данного процесса является изменение стимуляции резидентных макрофагов, стромальных механоцитов, эндотелия, увеличение локальной продукции цитокинов и ростовых факторов (ИЛ-1,3, ФНО) и, как следствие, увеличение массы СККХ и ПКПКХ. Блокада любого из вышеуказанных процессов приводит к супрессии или полной отмене ДКМА (Шахов, 1996; Шахов, Шахова, 1996).
Остеогенные прекурсоры в процессе своего развития дифференцируются в бипотентные, затем унипотентные костные клетки-предшественники, которые затем, после 6-8 митозов, превращаются в остеобласты. Остеобласты, в свою очередь, совершив 2-3 деления, трансформируются в специализированные клетки-остеоциты.
Количество клеток-предшественников в костной ткани составляет не более 0,01-0,1%, причем большая часть из них приходится на долю коммитированных, би- и унипотентных прекурсоров. Число более дифференцированных элементов-остеобластов и хондробластов достигает 1-10% от общего количества костных или хрящевых клеток, и их распределение зависит от места взятия материала для исследования. Наибольшее число предшественников остеобластов и остеоцитов располагается на границе костной и хрящевой ткани, в зонах активной перестройки костной ткани и резко возрастает при травмах и переломах костной ткани.
Другой эшелон клеток костной ткани представлен морфологически дифференцируемыми клетками: остеобластами, остеоцитами и остеокластами.
Остеобласты
Gegenbauer в 1864 г. впервые описал клетки, получившие название «остеобласты». Это относительно крупные секреторные клетки, имеющие кубическую форму, базофильную цитоплазму с хорошо развитой гранулярной эндоплазматической сетью и эксцентрично расположенное ядро. На мембране имеются рецепторы для коллагена, остеокальцина, остепонтина, ИПФР, ФРФ, ТРФ, в цитоплазме высока активность щелочной фосфатазы. Вакуоли остеобластов формируют секреторные пузырьки, содержащие проколлаген, коллаген, липиды, фосфолипазы. Вакуоли образуются внутри цитоплазмы и движутся к апикальной части, где могут выбрасывать свое содержимое наружу посредством экзоцитоза. Другие включения, получившие название «матриксные пузырьки», играют ключевую роль в процессе минерализации костного матрикса и обнаруживаются в месте кальцификации кости. Они имеют диаметр от 30 до 1000 нм, структура их стенок идентична наружной мембране клетки, содержат липиды, пирофосфатазу и кальций. Предполагается, что в них происходит накопление кальция, который взаимодействует с ортофосфатами, образующимися в результате гидролиза эфира фосфорной кислоты при участии фосфатазы. Это обеспечивает локальное увеличение значение Са/Р и вызывает преципитацию с возрастанием концентрации свободных ионов фосфатов. Именно они, по-видимому, взаимодействуют с несвязанным белками кальцием в тканевой жидкости. Первоначально образуется аморфный Са3(Р04)2, а затем - гидроксиапатит (ГА). Считается, что в регуляции этого процесса важную роль играет витамин D, а также неорганический пирофосфат, выполняющий роль ингибитора в механизме кальцификации. Считается, что вышедшие в экстрацеллюлярное пространство матриксные пузырьки вступают во взаимодействие с протеогликанами, остеонектином и коллагеном, встраиваясь в их структуру, и после удаления оболочки могут выступать в качестве маргинального фактора для запуска локального эндогенного механизма обызвествления кости (Хэм, Кормак, 1983; Anderson, 1976).
В цитоплазме остеобластов обнаруживаются актиноподобные микрофиламенты с толщиной около 5-7 нм, которые, по-видимому, играют важную роль в их перемещении (King, Holtrop, 1975). Митотическая активность этих клеток в обычных условиях относительно низкая, но резко увеличивается при действии экстремальных факторов, переломах, травмах. Остеобласты располагаются в неминерализованном костном матриксе вокруг остеона. В обычных условиях они практически не делятся, но при повреждении костной ткани могут проявлять митотическую активность (Фриденштейн, Лалыкина, 1973). Остеобласты секретируют и наслаивают новый костный матрикс, располагаясь на поверхности уже существующего материала. Часть из них постепенно погружается в него, постепенно дифференцируясь в остеоциты. Новую кость остеобласты откладывают в виде концентрических слоев, в центре которых располагается кровеносный сосуд. Эта система называется остеоидом. Его средний размер около 80-200 мкм (Хэм, Кормак, 1983). Далее мы увидим, что эти размеры являются определяющим фактором в построении новой костной ткани на пористой кальциофосфатной керамики.
Остеоциты
Остеоциты находятся в замкнутых лакунах и не пролиферируют, но частично сохраняют способность продуцировать коллаген и протеогликаны. Между собой костные клетки соединены узкими каналами, через которые поддерживается между ними связь и, очевидно, регулируются процессы минерализации костной ткани и скорость остеогенеза. Несмотря на большое количество данных, посвященных морфофункциональным свойствам остеоцитов, тем не менее, информации об их роли в метаболизме кости все еще крайне не достаточно (Belange et al., 1966). По-видимому, остеоциты играют большую, чем им приписывается, роль в кругообороте костной ткани и кальция. Кроме того, через массивные клеточно-матричные контакты они принимают активное участие в обмене ионов, а также выступают в роли механических биосенсоров, реагирующих на изменение нагрузки на костную ткань (Aarden et al., 1994).
Возможно, именно это свойство лежит в основе широко известного закона Вольфа, согласно которому структура костной ткани прямо пропорционально зависит от действующих на нее нагрузок (Wolf, 1870, 1892).
Остеоциты имеют на своей поверхности рецепторы к ОВ 7.3 антителам и паратиреоидному гормону, дают положительную реакцию на щелочную фосфатазу, хотя и в меньшей степени, чем остеобласты. Под действием паратгормона в цитоплазме увеличивается уровень цАМФ, который не возрастает у остеобластоподобных клеток. По-видимому, они играют важную роль в кальциевом гомеостазе через остеолизис (Van der Plas et al.,1994).
Обнаружено накопление большого количества экстрацеллюлярного остеокальцина, связанного с минералами. Этот процесс связан с работой ферментов казеинкиназы II и экто-5 нуклеотидазы в остеоцитах. Казеинкиназа II, как известно, принимает участие в выработке костного адгезина-сиалопротеина II. При этом, если в остеоцитах экспрессия данного фермента была выражена хорошо, то в остеобластах она была минимальной. Считается, что в процессе созревания костных клеток происходит увеличение экспрессии генов, ответственных за выработку белков адгезии, и, как следствие, происходит более прочная фиксация клеток в костном матриксе (Mikuni-Takagaki et al., 1995).
Остеокласты
В то время как остеобласты и остеоциты образуют костный матрикс, в кости существуют клетки, разрушающие его. Они получили название остеокластов. Эти клетки не являются остеогенными, а развиваются из кроветворных прекурсоров, дифференцирующихся в сторону моноцитопоэза. При попадании моноцитов в костную ткань они проходят специализацию и превращаются в остеокласты (Учитель, 1978; Карр, 1978; Kurihara et al., 1990; Hattersley et al., 1991).
Остеокласты представляют собой крупные многоядерные клетки, образующиеся в результате слияния до 50 моноцитов-макрофагов. Затем они мигрируют к участкам, где происходит активная резорбция костной ткани. Механизм, регулирующий продвижение и точное попадание фагоцитирующих мононуклеаров к данным зонам, не совсем понятен. Считается, что этот процесс идет с участием остеогенных гормонов, хемотаксических факторов-МБК, КСФ, ИЛ-1, белков адгезии-фибронектина, альбумина, сиалопротеинов, адгезинов и других цитокинов. Кроме того, ряд факторов (КСФ, ИЛ-1 и др.) обладает способностью стимулировать продукцию и морфофункциональные свойства остеокластов (Girasole et al., 1992; Kamada et al., 1997). Затем через специализированный мембранный комплекс, образующий так называемую гофрированную каемку, осуществляется процесс секреции кислот, растворяющих кристаллы гидроксиапатита, ТКФ и различных ферментов типа коллагеназы и эластазы, для гидролиза коллагена и эластических волокон (Альбертс и др., 1994; Krstic, 1979). Обычно остеокласты группируются и прокладывают глубокие туннели со скоростью около 50 мкм в сутки. Вслед за ними устремляются остеобласты, которые выстилают стенки каналов, а в сам канал прорастают сосуды и нервные окончания, через которые происходит доставка питательных веществ и кислорода к ткани (Marcus, 1987). Специфическим гистохимическим маркером зрелых остеокластов является положительная реакция на тартрат резистентную кислую фосфатазу, а дифференцировочным - реакция на межклеточную карбонильную ангидразу II. В отличие от остеокластоподобных мультиядерных клеток, формирующихся путем слияния макрофагов, остеокласты несут на своей мембране рецептор к кальцитонину (Lomri, Baron, 1992).
Остеокласты - очень мобильные клетки, которые мигрируют и легко присоединяются к гидроксиапатиту с помощью молекул адгезии, среди которых к настоящему времени наиболее хорошо изучена группа интегринов. Интегрины представляют собой трансмембранные гетеродоменные гликопротеины с двумя α и β нековалентными цепочками. Они функционируют как рецепторы для большинства лигандов, включая матричные белки, имеющие последовательность аминокислот Арг-Гли-Асп (коллаген, витронектин, фибронектин, сиалоадгезин, эластин и др.). В результате их взаимодействия происходит реорганизация компонентов цитоскелета остеокластов. Кроме того, в остеокластах были обнаружены структурные гликопротеины, связывающиеся с молекулами адгезии: αω β3 цепочки для витронектина, α2 β1 - для коллагена и ламинина, и αЗ β1 - для коллагена, сиалоадгезина, фибронектина и витронектина (Nesbitt, 1993; Wada, 1995).
Остеокласты способны к продукции супероксидного кислорода (O2-), играющего важную роль в развитии воспалительной реакции. Образование O2- ингибируется при добавлении к культуре костных клеток супероксидцисмутазы (Key et al., 1994).
O2- обнаруживается на границе гофрированной каемки остеобластов с окружающей его костной тканью и, вероятно, участвует в биодеградации коллагена, остеокальцина и других белков органического матрикса, а также удалении трансформированных клеток и обезвреживании микроорганизмов при развитии эндогенного или экзогенного инфекционного процесса (Маянский, 1991). Механизмы регуляции выработки суперкосидных форм кислорода при воспалении достаточно хорошо описаны в монографиях А.Н. Маянского, Д.Н. Маянского (1989), Д.Н. Маянского (1991), и мы не будем подробно останавливаться на этом процессе. Единственное, что хотелось бы отметить, что образование O2- в остеокластах находится под контролем Са++ и NO, причем последний мессенжер вырабатывается и утилизируется клетками эндотелия и костными клетками, т.е. является паркринным и аутокринным регулятором. NO ингибирует процесс резорбции костной ткани остеокластами и имеет короткий период жизни, разрушаясь эндотелеином (Datta et al., 1995).
Костные клетки функционируют в среде, получившей название «костный матрикс». По своему качественному составу он является ничем иным как соединительной тканью, отличающейся от других типов наличием развитой минеральной составляющей, способной, очевидно, к самоорганизации.
С теоретической позиции это свойство КФ вызывает особый интерес, т.к. может лечь в основу создания на их основе материалов нового поколения с программируемыми биологическими свойствами.
Экстрацеллюлярный матрикс
Костная ткань на 60% состоит из минеральных веществ (доминирует гидроксиапатит), на 30% - из органических субстанций (коллагеновые волокна - до 90-95%, протеогликаны, гликозаминогликаны, фибронектин, остеонектин и др.), и на 10% - из воды, находящейся в связанном и свободном состоянии. Экстрацеллюлярный (внеклеточный) матрикс костной ткани является результатом продукции остеобластов и остеокластов, на 95% состоит из коллагена преимущественно 1-го типа и неколлагеновых протеинов (5%), которые образуют единую структурно-функциональную систему. Различают минеральную (неорганическую) и неминеральную (органическую) составляющие внеклеточного вещества костной ткани. (Хэм, Кормак, 1983; Альбертс и др., 1994; Улумбекова, Гелышева, 1997).
Минеральный (неорганический) матрикс
Вода. Около 85% воды содержится в органической матрице вокруг волокон коллагена и основного вещества и в гидратированной оболочке, окружающей костные кристаллы ГА. Другие 15% находятся в каналах и полостях, окружающих костную оболочку, и доставляют питательные вещества тканям кости. Вода придает упругие свойства костной ткани. В компактной кости содержится около 10% воды, а в губчатой -около 5-15% (Ньюман et al., 1961; Хэм, Кормак, 1983; Омельянченко и др., 1997).
Неорганическая часть содержит преимущественно два химических элемента - кальций и фосфор, составляющих 35 и 50% соответственно. Они придают кости ее плотную консистенцию. Кость служит резервуаром основных минералов в теле, в частности кальция (98%), фосфора (85%), магния (50%) и натрия (45%) (Ткаченко, Пятынина, 1996). Остальные 15% приходятся на бикарбонаты, цитраты, фториды, различные соли и микроэлементы. Кости содержат: Са3(РO4) 2 - 60%, СаСO3 -5,9%, Mg3(PO4) - 1,4%, MgO - 0,72%, Na2O - 0,99%, К2O -0,07%, SiO - 0,04%, СO2 - 3,48%, F - 0,07%, Cl - 0,08%. Наиболее важными микроэлементами являются Cu, Zn, Sr, Ва, Be, Al, Mo, Au, Mn, Fe, Si и др.
Считается, что дефицит или увеличение количества этих соединений может играть ведущую роль в процессах обновления кристаллической решетки костных минералов, определяет ее пространственную структуру, от которой во многом зависят прочностные характеристики костной ткани (Ермакова и др., 1990; Омельянченко и др., 1997).
Необходимо остановиться подробнее на распределении кальций-фосфатов в тканях и органах человека, которые составляют единую систему. Они включают в себя:
- аморфные фосфаты кальция (АФК);
- брушиты или дигидраты дикальций-фосфатов (ДДКФ), СаНРO4 2Н2O;
- монетит или безводный дикальций-фосфат (ДКФ), СаНРO4;
- октакальций-фосфат (ОКФ), Са8Н2(РO4)6-5Н2O;
- витлокит или трикальций-фосфат (ТКФ), Са3(РO4)2;
- дигидрат пирофосфата кальция (ДПК), Са2Р2O7;
- апатит, кальций-ОН-апатит, как Са10(РО4)6(ОН)2 (ГА). Витлокиты обычно являются магнийзамещенными, в виде Ca,(Mg)3(PO4)2, и должны рассматриваться как β-ТКФ.
Биологические апатиты не являются чистыми ГА, а, как правило, являются карбонатзамещенными апатитами с дефицитом кальция.
Дигидрат пирофосфата кальция распространен при патологическом кальцинозе.
Другими соединениями кальция, представляющими интерес в ортопедии и стоматологии, являются фторид кальция CaF2 и кальцитовая форма карбоната кальция CaCO3 (LeGeros, 1991).
Гидроксиапатит (гидрокситапатит, трикальций-фосфат)
В 1926 г. Дийонг и Гросс, Мехмель, используя рентгенодифракционный анализ, установили, что гидроксиапатит является главным неорганическим компонентом костей, эмали зубов и дентина (Везер, 1962; Корбридж, 1982). Термин «апатит» ввел Вернер в 1788 г. для фосфорсодержащих минералов.
Около 50-60% от массы всей костной ткани приходится на минеральное вещество, преимущественно состоящее из кристаллов и (в меньшей степени) коллоидных растворов ГА, имеющих формулу:
Са10(РО4)6(ОН)2х ([Са3(РO4)2]3х Са(ОН)2).
Нерастворимые фосфаты кальция присутствуют в кости в виде стабильных (кристаллы гидроксиапатита, карбоксилапатита) и лабильных (аморфных) фосфатов. Последние покрывают поверхность ГА. В результате динамических процессов рекристаллизации и кристаллизации, с участием изотопов каль-ция-45, введенных в организм, наблюдается бурное в течение часа включение их в структуру кости, после чего они не обнаруживаются в лабильной форме. Скорость поглощения меченого кальция составляет 27 мг за 15 мин (Фриденштейн, Лалыкина, 1973; Касавина, Торбенко, 1979). Во многом аналогичную кинетику связывания с костной тканью проявляют и радиоизотопы фосфора (Leblond et al., 1950). Наши данные с использованием меченых технецием пирофосфатов на крысах линии Вистар показали, что 95-97% изотопа прочно связываются с костной тканью с выходом на плато в течение 3-4 часов после внутривенного введения. Из скелета может выделиться такое количество кальция, которое в три раза превышает его содержание во внеклеточной жидкости. Кроме того, в опытах на животных показано, что в течение короткого времени содержание кальция в костях можно уменьшить на 20%. Такой интенсивный обмен минеральных веществ свидетельствует о том, что костная ткань является не только депо, но и буферной системой кальциофосфатов, позволяющей поддерживать постоянство концентрации данных ионов в крови и организме (Касавина, Торбенко, 1979). В силу скоротечности этого процесса его нельзя объяснить только за счет поглощения костными клетками КФ, а затем встраиванием их в структуру новообразованных кристаллов ГА. Такой механизм, очевидно, тоже имеет место, т.к. при использовании меченых изотопов глицина цистеина, метионина и фосфора, время включения этих молекул, идущих через продукцию остеобластами нового костного матрикса, составляет не менее 35 часов (Carneiro, Leblond et al., 1959). Тем не менее, можно полагать, что часть экзогенного кальция способна к прямому быстрому связыванию или встраиванию в структуру кальциофосфатов кости.
Мы предполагаем, что этот процесс происходит по типу селективной эндогенной кристаллизации в насыщенных растворах, т.к. известно, что часть ГА способна продолжать свой рост в костной ткани и после их высвобождения из везикул остеобластов, путем адсорбции на своей поверхности кальция и фосфора из окружающих его жидкостей (Ткаченко, Пятынина, 1996). Тем не менее, механизм этого явления к настоящему времени остается все еще малоизученным. Ниже мы более детально рассмотрим гипотезу об эндогенной кристаллизации и ее роли в образовании новой костной ткани на имплантируемых устройствах.
Кристаллы гидроксиапатита имеют преимущественно гексагональную форму, построенную из колонок Са2+ и атомов О, принадлежащих фосфатным группам, которые образуют стенки каналов, идущих параллельно гексагональным осям (Корбридж, 1982). В костной ткани средние размеры элементарной ячейки составляют около 20x5x1,5 нм. Причем длинная ось ее ориентирована параллельно осям коллагеновых фибрилл, кристаллы сгруппированы в виде стержней (диаметром около 50 А, длина - 2000 А) и соединяются с коллагеном через остеонектин (Касавина, Торбенко, 1975). Такая структура придает материалу высокую прочность на растяжение и сжатие, приближающуюся к прочности мягких марок сталей. Однако, в отличие от последней, кости намного легче, более эластичны, способны к гистерезису и регенерации в процессе роста и заживления. В то же время между синтетическими и биологическими апатитами существует принципиальное различие. Теоретически синтез ГА может протекать в живом организме по достаточно простой реакции, которую можно описать следующим образом:
10СаНРO4 + nН2O = 4Н3РO4 + Са10(РО4)6(ОН)2 + (n-2)Н2O.
В реальных условиях этот процесс протекает гораздо сложнее и в нем остается много неясного. По одной из гипотез считается, что минерализация костного матрикса происходит за счет первоначального образования аморфного кальциофосфатного соединения с последующей его кристаллизацией в гидроксиапатит внутри волокон коллагена (Корбридж, 1982). В то же время было показано, что концентрация Са2+ и РO43- в лакунарно-канальциевой жидкости превышает критический уровень для спонтанного осаждения солей кальция. Предполагается, что в организме существует специальная система стабилизации, предупреждающая преждевременную кристаллизацию кальциофосфатов в ГА (Улумбекова, Челышева, 1997). Кроме того, необходимо учитывать, что структура и размеры элементарных ячеек напрямую связаны с наличием примесей различных микроэлементов и условием формирования кристаллов, которые могут выступать как катализаторы и модификаторы ГА (Омельянченко и др.,1997; ChristoEfersen, Christoffersen, 1992; Christoffersen et al., 1995).
ГА образуется в результате процесса, протекающего в вакуолях остеобластов и остеоцитов, при участии фосфолипаз и фосфатаз. По мере роста кристаллов вакуоли отпочковываются в экстрацеллюлярное пространство, где из них выходит ГА, который продолжает увеличиваться в размерах, по видимому, за счет адсорбции на себе кальциофосфатов из окружающего его лабильного слоя или непосредственно из тканевой жидкости (Хэм, Кормак, 1983, Ткаченко, Пятынина, 1996).
В костной ткани кристаллы ГА, как правило, полиморфны и могут иметь игольчатую или пластинчатую структуру различной толщины, ширины и длины. Прослеживается взаимосвязь между структурой кристаллов ГА и возрастом, обменом минералов, физической нагрузкой, состоянием коллагеновой матрицы и рядом других факторов (Омельянченко и др., 1997).
Следует еще раз подчеркнуть, что разделение кости на неорганический и органический матрикс целесообразно только с химической и физической, но не с функциональной сторон. Это тесно взаимосвязанные системы, многие из реакций которых до сих пор не удается получить в модельных экспериментах. Например, центры кристаллизации гидроксиапатита образуются в участках поперечных полос коллагена через молекулы остеонектина, который имеет высокое сродство к коллагену I типа и ГА. В этом процессе активную роль играют различные ионы (Mn, Sr, Cu, Va, F, Pb, Со, Al, Sn и др.), остеокальцин, полипептидные факторы, витамины и клетки остеона (Скоблин, Белоус, 1968; Ермакова и др.,1990). Оказалось, что нарушение естественного баланса микроэлементов при образовании кристаллов ГА приводит к деформации его кристаллической решетки. Это, в конечном счете, вызывает нарушение принципа непрерывности структурно-функциональной целостности кости, изменение ее биомеханических и биологических свойств (Ymaha et al., 1997). Тем не менее, до настоящего времени тонкие механизмы взаимодействия между коллагеном и ГА поняты плохо и требуют дальнейшего изучения.
Вместе с коллагеном кристаллы гидроксиапатита формируют сложную прочную архитектуру костной ткани, обладающей огромной активной поверхностью, составляющей около 130—270 м2 на 1 г матрикса (Корбридж, 1982). Так, например, поликристаллическая поверхность ГА имеет гигантские размеры, достигающие у человека общей площади около 2000 км2. Это заставляет задуматься о том, насколько важна роль гидроксиапатитов в обмене разнообразных веществ, начиная от кальция и фосфора и заканчивая другими микроэлементами и органическими молекулами, депонированными в костной ткани (Касавина, Торбенко, 1979).
Аморфные кальциофосфаты
Гидроксиапатит и его производные составляют лишь доминирующую часть минеральной фазы костной ткани. Другие компоненты представлены преимущественно аморфным фосфорнокислым кальцием, являющимся прямым продуктом деятельности остеобластов и остеоцитов.
Предполагается, что существуют два механизма образования аморфных кальциофосфатов. Один реализуется через накопление данного вещества внутри клетки в виде гранул, которые затем секретируются в межклеточное пространство. Другой путь связан с переходом свободного или связанного с органическими компонентами кальция через мембрану в межклеточное пространство. Образовавшийся аморфный кальций является источником ионов Са для ГА. Между ними существует динамическое равновесие, зависящее от возраста, пола, содержания витамина D, микроэлементов, гормонов и других факторов. При этом фосфорнокислый кальций является более растворимой и биологически активной субстанцией, чем ГА (Касавина, Торбенко, 1979; Ledgers, 1991).
Как уже отмечалось, около 80-90% всех фосфатов содержится в костях, которые постоянно контактируют с фосфатами, циркулирующими с кровью, лимфоцитами и другими тканевыми жидкостями, формирующими естественные буферные системы организма (Корбридж, 1982).
Следует подчеркнуть, что соотношение кальция и фосфора в ГА равно 1,62, а в β-ТКФ - около 1,5 (Корбридж, 1982).
Микроэлементы
Характерная особенность микроэлементов заключается в том, что они в чрезвычайно низких концентрациях выступают в роли катализаторов или активаторов ферментов, гормонов, витаминов и других биоактивных молекул. В костной ткани обнаружено свыше 30 микроэлементов. Так, магний и цинк являются активаторами щелочной фосфатазы. Избыток бериллия, алюминия, марганца и стронция приводит к развитию рахитоподобных состояний. Стронций конкурирует с кальцием за место в кристаллах ГА. В губчатой кости стронция в 3 раза больше, чем в компактной. Магний, барий и кобальт могут встраиваться в структуру ГА, изменяя его физико-химические и биологические свойства (Касавина, Торбенко, 1979).
Органическая часть костного матрикса
Органическая часть костного матрикса состоит из коллагена (98%) и неколлагеновых белков (2%), в частности остеонектина, остеокальцина, протеогликанов, сиалопротеинов, морфогенетических белков, протеолипидов, фосфолипидов, гликозаминогликанов и органических кислот (Альбертс и др., 1994).
Коллаген
Коллаген является основным строительным белком костной ткани, определяющим ее конструкцию, прочность, упругость, жесткость, устойчивость к нагрузкам и деформациям. Выработка коллагена у человека контролируется семейством COL-генов, расположенных в различных хромосомах (COL 8А2, COL 9А2, COL 11 А1 - в 1-й паре хромосом, COL3A1, COL5A2, COL4a3,4 COL 6А - 2-й, COL 9А1 и COL17F1 - в 6-й, COL1A2 - 7-й, COL 5А - 9-й, COL 13 А1 - 10-й, COL-4A1,2 - 13-й, COL-1A - 15-й, COL 4 А1,2 - 21-й). Известно более 50 мутаций генов COL1A1 и около 30 COL1A2, которые приводят к развитию несовершенного остеогенеза. Как правило, такие заболевания передаются по аутосомо-доминантному, реже аутосомо-рецессивному типам, сопровождаются состоянием патологической хрупкости и пластичности костей, частыми переломами после легких травм, деформацией длинных костей и развитием остеосклероза. Мутация генов COL4A1, COL2A1 и COL1A1 приводит к формированию синдрома Элерса-Данло-Русакова - системному заболеванию соединительной ткани, которое клинически проявляется в виде разболтанности суставов, гиперэластичности кожи, легкой травматизации кожи и крупных артерий. Мутация генов COL2A1, COL 1А1 и COL2A - к индукции различных типов ахондрогенеза и ахондроплазии (карликовости) (McRusick, 1995).
Коллаген - сложный белок, состоящий из трех про-α-цепей. Длина спиралей около 300 нм, диаметр 1,5 нм. Все известные типы коллагена содержат участки с повторяющимися последовательностями из трех аминокислот с глицином в третьем положении и пролином или гидроксипролином во втором. В настоящее время известно около 17 видов коллагенов, среди которых в костной и хрящевой ткани наиболее распространены I, II, V, VI, IX, X (Альбертс и др., 1994).
Доля коллагена I типа составляет в костной ткани около 90-95%, остальная часть приходится в основном на V тип. В хрящевой ткани доминирует коллаген II типа (40%), а IX (5-10%) сшивает коллагеновые волокна в пучки и ковалентно связывает хондрохитинсульфат VI, X.
Тип I образует видимые фибриллы с периодичностью 67 нм. Сходная периодичность характерна и для II, III видов.
Волокна синтезируются остеобластами, фибробластами, гладкомышечными клетками, эпителием. Длительность секреции коллагена в остеобластах от момента начала сборки молекулы до включения его в структуру костного матрикса составляет около 35 часов (Carneiro, Leblond et al., 1959).
Трансляция и сборка полипептидных ос-цепей происходит в рибосомах гранулярной эндоплазматической сети. В цистернах комплекса Гольджи осуществляется их гидроксилирование и гликозилирование, что приводит к конформации молекул и образованию трех спиралей про-α-цепей (проколлаген), которые соединены между собой водородными, а на конце - дисульфидными связями. В этом процессе активную роль играет витамин С, дефицит которого сопровождается нарушением образования проколлагена, что в конечном счете приводит к развитию дефектов костей и зубов, нарушает процесс репарации и регенерации костной ткани при переломах.
Молекулы проколлагена накапливаются в везикулах остеобластов и других секреторных клеток и секретируются во внеклеточное пространство в виде тропоколлагена. У коллагенов IV и V типов не происходит отщепления концевых молекул, что объясняет отсутствие у них нитевидных структур.
Тропоколлагеновые биополимерные молекулы при сборке фибрилл выстраивают параллельно расположенные цепи последовательно конец в конец и сторона к стороне таким образом, чтобы между головными и концевыми участками оставалась щель диаметром около 35 нм. Следует отметить, что каждая молекула в цепи смещена относительно молекулы в соседней цепи на четверть ее длины, что морфологически определяется в виде поперечной исчерченности волокон. Этим достигается конструктивная прочность, упругость и эластичность соединения. Коллагеновая сеть, состоящая из многочисленных волокон, погружена в макромолекулярные агрегаты протеогликанов и тесно взаимодействует с межклеточным матриксом и кристаллическими молекулами гидроксиапатита, образуя прочную биомеханическую систему (Nordik, Win, 1991).
Коллагеновые волокна в костной ткани имеют строго определенную ориентацию. В компактной части трубчатых костей коллагеновые волокна входят в состав концентрических костных пластинок остеона, вставочных пластин и костных трабекул. Как правило, в составе остеона коллагеновые волокна располагаются в виде концентрических слоев, расположенных под определенным углом друг к другу, что обеспечивает биомеханическую устойчивость системы (Хэм, Кормак, 1983).
В волокнистом хряще между пучками коллагеновых волокон (тип 2) располагаются цепочки хондроцитов, проходящих параллельно друг к другу в одном направлении. В гиалиновом хряще можно различить надхрящницу, под которой располагаются хондробласты и молодые хондроциты, затем интертерриториальный и территориальный матрикс, в последнем зрелые хондроциты располагаются в лакунах или в форме изогенных хрящевых клеток. Коллагеновые волокна в хрящевой ткани окружены гипермолекулами протеогликанов, синтезируемых хондроцитами и остеобластами. Одной из основных функций протеогликанов является обеспечение диффузии веществ и связывание воды, что определяет упругость ткани (Альбертс и др., 1994).
Неколлагеновые компоненты экстрацеллюлярного матрикса
Хотя, как было сказано выше, на все остальные протеины костного матрикса приходится около 2%, тем не менее, они играют исключительную роль в обмене органических веществ, минералов, витаминов и микроэлементов. Они выполняют регуляторные функции, принимают активное участие в ремоделировании костной ткани в норме, при нагрузках и различных патологических состояниях, в том числе и переломах.
По функциональной активности, достаточно условно, их можно разделить на две подгруппы. Одна из них активно участвует в формировании микроархитектоники костной ткани, указывает расположение клеток, их связь с коллагеном и ГА. К ней можно отнести протеогликаны, гликозаминогликаны, фибронектин, гиалуроновую кислоту, остеонектин. Другая подгруппа обладает способностью воздействовать на адгезию, миграцию и функциональную активность остеогенных и вспомогательных клеток остеобластов и остеокластов. Она включает специфические остеотропные гормоны, ростовые, хемотаксические, трансформирующие дифференцирующие факторы (остеопонтин, остеокальцин, трансформирующий фактор опухоли, инсулиноподобный фактор, костные морфогенетические белки и др.) (Gilbert, 1994). Вместе с коллагеном они участвуют в формировании гуморальной составляющей костного микроокружения.
Остеонектин
Для связи кристаллов КФ с коллагеном типа I в костной ткани имеется еще один тип гликопротеинов - остеонектин, с молекулярной массой 32 кД, который осуществляет свою функцию через домены для Са++. Кроме того, остеокальцин участвует вместе с коллагеном в регулировании процессов осаждения Са++, РO43- из растворов в костной ткани (Улумбекова, Челышева, 1997).
Остеокальцин
Остеокальцин - белок, состоящий из одной цепи 46-50 аминокислот, содержит три γ-карбоксиглютаматовые, витамин-К-зависимые кислотные остатка, через которые происходит их связь с кальцием гидроксиапатита. Указанный протеин секретируется остеобластами. Предполагается, что он играет значительную роль в ремоделировании кости. Однако конкретные механизмы его участия в этом процессе остаются неясными. Тем не менее, при изучении влияния остеокальцина на процесс хемотаксиса, прилипания и функциональную активность остеокластов человека в системе in vitro было показано, что данный протеин оказывает свое влияние на процесс образования ячеек для остеокластов через сиалопротеины (СП), остеопонтин, фибронектин и систему 1,3 β-интегринов. При его отсутствии выше перечисленные адгезины лишь накапливались во внутриклеточных гранулах. Действие СП на остеокласты происходило в результате внутриклеточного увеличения кальция, при тапсигаргиночувствительных нагрузках с участием эндогенных адгезинов и интегринов (Chenu; Colucci, 1994).
Остеокальцин, полипептид (5,8 КД), производится остеобластами и одонтобластами. 75% связывается с минеральной частью костного матрикса, остальное количество находится в крови, почках, печени и других тканях (Eastell, 1994). Полипептид имеет высокое сродство к кальцию и ГА, по-видимому, через отрицательно заряженную γ-карбоксиглутаминовую кислоту, образование которой происходит с участием витамина К (Ingram et al., 1994). Считается, что остеокальцин является хемоаттрактантом для остеокластов и их предшественников. Механизм этого взаимодействия пока не расшифрован. Предполагается, что он реализуется с участием других цитокинов, например КСФ, с которым остеокальцин образует комплекс, адсорбирующийся на костном матриксе (Glowacki, Lian, 1987). Продукция остеокальцина находится под дистантным и локальным контролем. В первом случае это осуществляется через паратгормон и эстрадиол, а во втором - через простагландины и цитокины (Staal et al., 1992).
Протеогликаны
Коллагеновые волокна в хрящевой ткани окружены гипермолекулами протеогликанов, синтезируемыми хондроцитами и остеобластами (Cheney, Last, 1981). Одной из основных функций протеогликанов является обеспечение диффузии веществ и связывание воды, что определяет упругость ткани.
Желатиноподобное основное вещество, окружающее минерализованные волокна коллагена, состоит главным образом из протеогликанов (ПГ) и глюкозаминглюканов (ГАГ), образующих сложные комплексные макромолекулы. ГАГ играют роль цементирующего материала расположенного между слоями минерализованных волокон коллагена. ПГ представляют собой конгломерат гетерополисахаридов, связанных с белком, образующих в соединительной ткани волокнисто-подобную матрицу, содержащую в своем составе гликуроновую кислоту, на поверхности которой прикрепляются связывающие протеины, обычно через О-гликозидовую связь с сериновыми остатками в белке (Поликар, 1975; Луппа, 1980; Юшков и др., 1994).
От них в разные стороны отходят многочисленные цепи центральных белков. В свою очередь, к центральным белкам присоединяются олигосахариды, кератан сульфаты, гликозаминогликаны и различные ростовые факторы, образующие многомерную полифункциональную структуру (Bernifield, Sanderson, 1990; Massague, 1991).
Протеогликаны связываются с коллагеном через гликозаминогликаны и могут участвовать в регулировании диаметра соединительнотканных фибрилл. Структура макромолекулы протеогликанов и ее связи с коллагеном и другими компонентами экстрацеллюлярного матрикса представлены на рисунке.
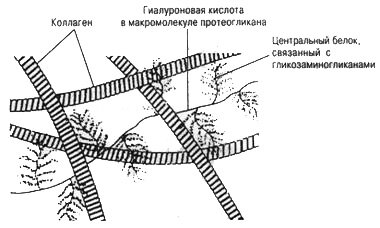
Структура макромолекулы протеогликанов и ее взаимодействие с коллагеном и неколлагеновыми белками экстрацеллюлярного матрикса (Kaplan, 1984)
Гликозаминогликаны
ГАГ - сложные полисахариды (кислые мукополисахариды), построенные из повторяющихся дисахаридных единиц, одна из которых - уроновая кислота, а другая - аминосахар (N-ацетил-глюкозамин, N-ацетилгалактозамин) (Юшков и др., 1994).
Различают кислые (отрицательно заряженные) и нейтральные типы ГАГ. В первой группе доминируют гидроксильные, карбоксильные и сульфатные группы. Гликозаминогликаны гидрофильны, связывают большое количество воды и ионов (Na+, Са++ и др.) с формированием коллоидного геля.
Выделяют пять основных типов ГАГ: гиалуроновая кислота, хондрохитинсульфат, дерматансульфат, кератансульфат, гепарансульфат и гепаринсульфат. В костной и хрящевой тканях преобладают хондрохитинсульфаты и гиалуроновая кислота (Gilbert, 1994).
Хондроитинсульфат (Хт)
Хт - полисахарид с молекулярной массой около 30 кД, состоящий из повторяющихся дисахаридов N-ацетилглюкозамина и D-глюкуроновой кислоты (Юшков и др., 1994).
Гиалуроновая кислота (ГК)
ГК имеет молекулярную массу около 1000 кД, содержит повторяющиеся дисахариды, состоящие из N-ацетилглюкозамина и D-глукуроновой кислоты. Так как макромолекула не содержит боковых сульфатных групп, то она не связывается ковалентно с белками.
Клеточные контакты с коллагеном типа I осуществляются через специализированный рецепторный аппарат, либо за счет образования сложного комплекса, состоящего, как правило, из коллагеновых фибрилл, ГАГ и фибронектина (Юшков и др., 1994).
Фибронектин (Фн)
Фн - гликопротеиновый димер, относящийся к макробелкам внеклеточного матрикса с м.м. 460 кД, отвечающий за адгезию, миграцию и определение места нахождения клеток в ткани. В хрящевой ткани роль фибронектина может выполнять другой во многом аналогичный ему белок - хондронектин, который взаимодействует с коллагеном II типа и хондроцитами (Юшков и др., 1994; Gilbert, 1994).

Опосредованная фибронектиновая связь клетки с коллагеновыми волокнами. Внеклеточная часть трансмембранного интегрина взаимодействует с фибронектином, который, в свою очередь, образует связь с молекулами коллагена (Jhonson, 1991)
Интегрины
В свою очередь, на клеточной мембране имеются специфические рецепторы для фибронектина - интегрины (Horwitz et al., 1986; Tamkun et al., 1986). Как уже указывалось выше, интегрины можно отнести к группе трансмембранных гликопротеинов, участвующих в процессах адгезии, взаимодействия между клеткой и другой клеткой, коллагеном и элементами экстрацеллюлярного матрикса, трансдукции сигналов, регулирующих пролиферацию и экспрессию генов. Они участвуют в формировании позиционной информации, хоминга молекул и клеток в строго определенные сайты клеточных мембран.
Интегрины состоят из гетеродимеров, объединяющих нековалентно связанные α, β-цепи. В настоящее время различают более 16 α- и 8 β-типов цепей интегринов. Большинство из них имеют цитоплазматический домен - β-цепь, который взаимодействует с примембранными микрофиламентами и белками цитоскелета - актином, талином и винкулином. На костных клетках экспрессируется один из типов адгезинов - сиалоадгезин (Wang et al., 1993).
Молекулы адгезии
Различают семейство кадгеринов (Е, М, N, Р-типы) и надсемейство Ig. По-видимому, в костной ткани наибольшая роль принадлежит кальцийзависимому М-кадгерину.
Следует отличать молекулы адгезии от факторов адгезии. К последним принадлежат такие биомолекулы, как фибронектин, ламинин, альбумин, коллаген, поли-D-лизин и др.
Деградация компонентов экстрацеллюлярного матрикса осуществляется остеокластами и макрофагами с помощью специфических металлопротеаз. Так, коллагены I, II, III расщепляются с помощью коллагеназы; эластин и коллаген IV, V - желатиназой или эластазой; протеогликаны, фибронектин и ГАГ -стромиелизином. Следует отметить, что при травме активация генов, ответственных за выработку коллагеназы, осуществляется под воздействием плазминогена и плазмина, активно образующихся в сгустке крови (Matrisian, 1992).
Коллаген, остеопонтин, сиалопротеин, тромбоспондин, фибронектин имеют в себе RGD-последовательность аминокислот, которые служат местом связывания интегринов, остеогенных клеток, остеобластов и остеокластов. Так, коллаген I типа имеет 6, а фибронектин - 2 таких последовательности аминокислот (Helfrich et al., 1992; Grzesik, Robey, 1994). Предполагается, что RGD-регионы принимают участие в пространственном распределении различных типов костных клеток в ткани. Исходя их этого, можно считать, что механизмы, контролирующие их образование или биодеградацию, являются по своей сути морфообразующими и, следовательно, занимают ключевое место в остеогенезе. Одним из путей их реализации является утилизация сиалоадгезина II и остеопонтина, являющихся фосфопротеинами, с помощью фосфатаз, секретируемых остеокластами (Horne et al., 1993; Ek-Rylander et al., 1994). Такая сложная белковая организация костной ткани позволяет сохранить все необходимые биомеханические и функциональные свойства при постоянно идущем ремоделировании кости и действии многократно изменяющихся нагрузок.
Органические кислоты
Содержание лимонной кислоты в костной ткани достигает 90% общего количества данного соединения в организме. Кроме лимонной кислоты в костях присутствуют янтарная, кетоглутаровая, фумаровая и другие кислоты. Они находятся в свободной и связанной формах. Считается, что метаболически активными веществами являются растворимые кислоты, т.к. они принимают участие в цикле трикарбоновых кислот. Кроме того, лимонная кислота, благодаря своей способности образовывать комплексы с ионами Са, играет важную роль в растворении солей кальция, повышая их концентрацию до такого уровня, когда становится возможным их кристаллизация и минерализация (Касавина, Торбенко, 1979).
А.В. Карпов, В.П. Шахов
Системы внешней фиксации и регуляторные механизмы оптимальной биомеханики

