Учебные материалы
Конектбиофарм
Работа
Компании
Реклама от Google
Редкие обменные заболевания костей
Категории: Костная патология, Метаболические заболевания костей,
Болезнь Кашина—Бека
Болезнь Кашина—Бека (уровская болезнь) впервые была описана жителем города Нерченска И.М. Юренским в 1849 г. в «Трудах вольного экономического общества» под названием «Об уродливости жителей берегов речки Урова в Восточной Сибири», затем двумя военными врачами казачьих войск Н.И. Кашиным в 1860 и 1861 гг. и Е.В. Беком и его супругой А.Н. Бек в докторской диссертации 1906 г. «К вопросу об osteoartritis deformans endemika в Забайкальской области» (отсюда и название болезни). В 1929 г. была открыта Уровская научно-исследовательская станция на источнике, вода которого оказывает благоприятное действие при этой болезни. Изучением занимались многие ученые — Ф.П. Сергиевский, В.А. Тихонов и др.
По данным ряда авторов, частота заболевания в различных местностях и в разные годы неодинакова. По сообщению В.А. Тихомирова (1976), болезнь Кашина—Бека не сокращает продолжительности жизни, но ограничивает физическую трудоспособность: «не столь важно прибавить годы к жизни, как прибавить жизнь к годам». Болезнь Кашина—Бека — эндемическое заболевание, распространенное в Амурской, Читинской областях, Монголии, некоторых областях Китая, Тибета, единичные случаи встречаются и в Средней Азии, в Европейской части России. В настоящее время общепринятой считается теория, согласно которой болезнь возникает в результате дисбаланса поступления макро- и микроэлементов с водой и пищей в определенных географических областях, имеющих особые геолого-географические особенности: близкое к почве расположение вечной мерзлоты, богатые различными минералами горные породы, по которым протекают реки, и в результате — необычное для других районов соотношение макро- и микроэлементов как в растительных, так и в животных продуктах питания сельских и городских жителей этих регионов. В последние годы исследователей интересует вопрос — индуцируется ли болезнь Кашина—Бека микотоксинами.
Болезнь обычно проявляется в детском и подростковом возрасте (5— 14 лет). Нервно-психические изменения вначале малозаметные, но иногда дети испытывают затруднения в учебе. Применяют общеукрепляющее лечение, витамины, элеутерококк, курортное лечение; хлеб, картофель, мясо и т.п. заменяют продуктами, привозимыми из других регионов.
Особенно типичными при болезни Кашина—Бека являются изменения костной системы. Больные, как правило, небольшого роста. Разные авторы разделяют болезнь на две или четыре стадии. В I стадии клинические проявления отсутствуют, однако на рентгенограммах отмечаются смазанность, бесструктурность эпифизов средних фаланг II—IV пальцев и одновременно неровность субхондральной пластинки, очаговые изменения — ниша в ногтевой фаланге I пальца или средней фаланге V пальца. Иногда — хруст в суставах или преходящие ноющие боли. Для II клинической стадии характерны ноющие тупые боли в суставах, короткопалость, хруст при движениях, особенно в суставах кистей, коленных, голеностопных. На рентгенограммах к указанным изменениям прибавляются уплощение эпифизов, зоны кистозно-лакунарной перестройки, явления деформирующего артроза, изменения в позвоночнике, легкая атрофия мышц, «утиная» походка. Стадии III—IV наблюдаются у больных старшего возраста — от 40 до 70 лет, у которых все симптомы более выражены: небольшой рост, симметричность поражения суставов, хруст при движениях, симметричные деформирующие артрозы, но без реактивного синовита.
М.Р. Елисеева и др., наблюдавшие больного с болезнью Кашина—Бека в Узбекистане, указывают, что спорадически заболевание встречается на Волге, в Пскове. Киеве, Ленинграде [Тихонов В.А., 1976; Росин И.В., 1982]. После проведенного лечения (стекловидное тело, витамины группы В, никотиновая кислота, индометацин, физиотерапия, ЛФК, массаж) отмечено улучшение.
А.В. Ващенко, К.Р. Седов, В.Н. Иванов (1988) провели ряд исследований, которые позволили установить: «... в Читинской области имеется провинция с недостаточностью селена (Улетовский район), где болезнь Кашина—Бека никогда не была зарегистрирована»; «в районах эндемии болезни Кашина—Бека содержание селена в почве, растениях, продуктах питания не понижено». Авторами проведены исследования 1520 образцов горных пород в районе эндемии с анализом 46 элементов; выявлено лишь повышенное содержание фосфата и марганца. Эта же закономерность обнаружена в почвах. По их мнению, накоплению марганца и фосфора способствуют близко расположенная к поверхности многолетняя мерзлота и болотистая местность. Это препятствует оттоку почвенных коллоидов. Авторы установили, что уровень кальция в горных породах, почве и водах эндемичных районов практически не отличался от его уровня в контрольных местностях. В почвах районов, эндемичных по болезни Кашина—Бека, было также выявлено повышенное содержание полифосфатов, причем существовала прямая зависимость их содержания от степени пораженности эндемией. Согласно исследованиям авторов, содержание макрои микроэлементов в продуктах питания и травах было нормальным. Содержание фосфора в пшенице в районе эндемии составило 5470±72,7 мг/кг, тогда как в контрольном — лишь 3324±79,8 мг/кг; в картофеле соответственно— 882,3±6,3 и 380,0±6,02 мг/кг. Достоверно повышенным было также содержание неорганического фосфора в сыворотке и марганца — в цельной крови. Уровень кальция был нормальным. Выделение с мочой неорганического фосфора и марганца — повышено.
Данные, полученные А.В. Ващенко и др., весьма убедительны. На основании своих исследований авторы выдвинули фосфатно-марганцевую гипотезу происхождения болезни Кашина—Бека. В различные ее стадии изучаемые показатели меняются, а избыточное поступление фосфора способствует гиперфосфатемии, гиперфосфатурии, гипокальциемии, что вызывает реакцию со стороны околощитовидных желез: повышение выработки паратгормона приводит к остеопорозу. Однако в заключение авторы подчеркивают, что патогенез болезни Кашина—Бека очень сложный и его нельзя свести только к изменению содержания фосфатов и марганца в организме.
И.В. Росин (1995) обследовал 20 больных, страдающих болезнью Кашина—Бека, в возрасте от 40 до 66 лет. В суточной моче определялась экскреция гликозаминогликанов — 10,7+0,12 мг/сут, гиалуроновой кислоты — 5,6±0,28 мг/сут, хондроитинсульфатов — 5,12±0,32 мг/сут. После лечения трилоном Б в виде фенофореза уменьшились боли в суставах, увеличился объем движений. Содержание гликозаминогликанов повысилось до 11,83±0,21 мг/сут (норма 21,15±0,14 мг/сут), снизился уровень гиалуроновой кислоты — 3,66+0,41 мг/сут (норма — 1,85+0,02 мг/сут), повысилась концентрация хондроитинсульфатов — 8,17+0,76 мг/сут (норма — 19,30+0,16 мг/сут). Автор считает перспективным поиск более эффективных комплексонов для лечения.
По его же данным, уровень гликозаминогликанов в моче больных во II стадии заболевания был достоверно понижен в сравнении с уровнем у здоровых людей (3,61±0,13 и 12,99±1,6 мг/сут). Было отмечено повышение экскреции с мочой гиалуроновой кислоты, гепарина, снижение хондроитинсульфатов. Количество фруктозы в сыворотке крови достоверно повышалось, содержание сиаловой кислоты снижалось, а уровень общих гексоз несущественно увеличивался, концентрация сиаловой кислоты и общих гексоз понижалась несущественно.
Эти и другие исследования и их трактовка дают основание считать, что все процессы, происходящие в организме при болезни Кашина—Бека, усиливают развитие склеротических и фибротических процессов в хряще и кости, нарушая остеогенез — раннее синостозирование эпифиза и метафиза с образованием брахифалангии.
По мнению А.П. Иено (1974), все это происходит, очевидно, в результате торможения синтеза коллагена II и I типов хряща и кости вследствие ингибирования железом активности ферментов гидроксилирования пролина и лизина, а также недостаточного поступления в организм аскорбиновой кислоты. М.А. Риш (1989) указывает на тормозящее действие цинка, что вызывает уменьшение активности проколлагенпептазы, а Ю.И. Москалев (1985) приписывает тормозящее действие и марганцу. Перечисленные выше изменения приводят, как считает А.А. Дельвиг (1966), к образованию атипичных структур коллагена, нарушению формирования конечных связей в фибриллах. По данным В.П. Торбенко и Б.С. Касавиной (1977), снижение экскреции с мочой фукозы и сиаловой кислоты является результатом уменьшения синтеза сиалопротеина костной ткани, в связи с чем нарушается ее способность связывать катионы.
Из известных ПО элементов периодической системы Д.И. Менделеева в организме животных и человека находится не менее 86—88, причем биологическое действие установлено у 67 из них. Считают, что 12 элементов жизненно необходимы. По мнению В.М. Мищенко и соавт. (1973), в нормальном росте кости и при патологических изменениях в ней принимают участие не менее 30—40 микроэлементов. В эндемичных очагах болезни Кашина—Бека в организме наблюдается избыток стронция, бария, молибдена, цинка, бериллия, железа, свинца, серебра и недостаток кальция, магния, меди, никеля, кобальта. Такой дисбаланс микроэлементов, наблюдаемый в этих районах, естественно, нарушает процессы костеобразования в метафизарных зонах роста костей, закладку и формирование коллагеновых структур, протеогликанов, процессы минерализации и оссификации хряща. В. Truban, С. Balcik, N. Akkas (1997) в эксперименте показали:
«...Оба состояния — снижение или избыток селена в пище (нехватка витамина Е в пище) — обладали грубым эффектом на механические свойства костной ткани».
Модули эластичности исследуемых трех групп экспериментальных животных были на 15—30 % ниже контрольных значений. Исследование костной ткани под световым микроскопом показало, что изменения похожи на остеомаляцию.
И.В. Росин (1994) предполагает, что происходит ингибирование марганцем активности ферментов, участвующих в синтезе предшественников хондроитинсульфатов и кератосульфата.
Л.П. Никитина и соавт. (1981) сообщили об угнетении биологического окисления с переключением на анаэробный путь распада глюкозы. Есть указания на снижение скорости образования белка. И.В. Росин (1994) также отметил снижение содержания белково-связанного оксипролина в плазме крови и общего оксипролина в моче.
Болезнь Кешана — беломышечная болезнь
В настоящее время установлено, что недостаточное содержание селена в почве, воде, продуктах питания приводит к развитого болезни Кешана (впервые описанную в Китае в 1935 г. в округе Кешан), известной также под названием беломышечной болезни. Болезнь характеризуется нарушением обмена веществ, дегенеративными изменениями в скелетных мышцах, изменениями в сердце и других органах. Описаны различные формы этой болезни. Поскольку болезнь Кешана мало известна в нашей стране, а ее патогенез прямо связан с содержанием в крови селена, мы сочли необходимым привести краткую справку о ней.
К.Р. Седов, В.Н. Иванов, А.В. Бащенко и др. (1988) посвятили статью болезни Кешана (беломышечная болезнь), которая распространена среди животных и людей в Забайкалье. В крови животных уровень селена снижен в 3—10 раз, в крови людей — в 2—4 раза (по данным авторов, 20—60 мкг/л). Зимой 1935 г. болезнь была описана в округе Кешан в Китае, а затем она была диагностирована и в других районах Китая. Это заболевание может возникнуть у людей, переселившихся в район, где это заболевание эндемично, при этом заболевание проявлялось на севере Китая чаще зимой, на юге — летом. Формы течения болезни разнообразные — от латентного с общими симптомами до остро наступившей одышки, падения артериального давления с выраженной картиной сердечной недостаточности, поперечной блокады сердца и т.п. Патологоанатомы обнаруживают очаги перерождения миокарда, скелетных мышц, диафрагмы, которые дряблы, бледно-желтого цвета, а местами имеют беловатый цвет или вид белых пятен на участках лентовидной формы.
К.Р. Седов и соавт. (1988) обследовали более 1000 жителей селенодефицитного Улетовского района в Забайкалье. Они обнаружили, что у здоровых людей содержание селена составило 96 мкг/л, у детей — 84 мкг/л, тогда как у взрослых больных с выявленной кардиопатией содержание селена в крови было 30 мкг/л, у детей — 27 мкг/л. Они установили, что содержание селена в питьевой слабоминерализованной воде меньше 1 мкг/л, в коровьем молоке — ниже нормы в 8—20 раз, в мясе — в 3—12 раз, картофеле — в 3—9 раз. По расчетам авторов, суточное потребление селена у больных было в 2,5—4 раза меньше нормы. Они считают необходимым проводить в этих районах: 1) селенизацию продуктов местного производства; 2) назначать препараты, восполняющие функцию селена в организме (например, витамина Е); 3) применять препараты, улучшающие всасывание селена (соляная, аскорбиновая кислоты, желчегонные средства).
Некоторые метаболические артриты-периартриты
Подагра
В результате повышения в крови уровня мочевой кислоты в тканях откладываются в виде кристаллов ураты — натриевая соль мочевой кислоты. Мочевая кислота образуется в результате расщепления пуринов, в большом количестве содержащихся в мясе и рыбе. Отрицательное влияние оказывает регулярное употребление алкоголя, вина. В крови может возникнуть гиперуремия, если урат натрия (мочевая кислота) недостаточно выводится из организма почками. Верхняя граница содержания урата натрия в крови для мужчин 0,42 ммоль/л, для женщин — 0,36 ммоль/л. Подагра, очевидно, связана с нарушениями нескольких генов, поскольку образование мочевой кислоты — многоступенчатый биохимический процесс, проявления нарушений которого определяются у нескольких членов семьи, чаще у мужчин.
Известно несколько типов клинического течения подагры.
1. Постепенное, незаметное отложение микрокристаллов уратов натрия в соединительнотканных образованиях в окружности суставов, суставной сумке, менисках коленных суставов, под кожей с формированием округлой формы образований микро- и макротофусов, иногда достигающих в диаметре несколько сантиметров (рис. 9.1). У некоторых больных мочекислые соли вызывают узурацию кости, что иногда приводит к перелому кости; чаще эти скопления можно удалить хирургическим путем, у других требуется резекция кости на протяжении или ампутация II—III фаланги пальца, поскольку чаще поражаются стопы и кисти рук.
2. Острые приступы подагры возникают у большинства больных периодически, в периоды нарушения выведения мочевой кислоты почками после многодневного запоя, когда, как правило, у больных нарушается аппетит. Алкоголь способствует увеличению концентрации мочевой кислоты, а голодание — увеличению кетоновых кислот. К сожалению, острые приступы подагры периодически наблюдаются и у больных, соблюдающих строжайшую диету. Острый приступ характеризуется внезапно (часто ночью) возникающими сильнейшими болями в области пораженного сустава, увеличением припухлости, покраснением кожи и быстрым подъемом температуры тела, иногда до 40 °С; нарастают лейкоцитоз, СОЭ. Острая воспалительная реакция синовиальной оболочки, всего тофуса, располагающегося параартикулярно, обусловлена, по данным D.MacCarty и J. Hollender (1961), образованием и выпадением в полость сустава микрокристаллов урата натрия. Нередко кожа над тофусом истончается и образуется свищ, через который выделяется конгломерат мочевой кислоты; лечение хирургическое. Мы не видели ни одного больного с подагрой с 1941 по 1950 г., когда в России был жестокий голод.
3. Поражение почек у больного подагрой. Мочевая кислота, которая выводится почками, вызывает так называемую подагрическую почку: интерстициальный нефрит, гломерулосклероз и артериосклероз, т.е. нефросклероз, уратные камни, тофусы в паренхиме почки — все это способствует развитию почечной недостаточности и у значительного процента больных (до 40—45 %) ведет к смерти.
Лечение. Основное условие — соблюдение диеты: ограничение или отказ от мяса, рыбы, алкоголя и т.д. Назначают пиразолоновые препараты — бутадиен, реопирин, кетазон, фенилбутазон и т.д., а также препараты индольного ряда: индоцид, индометацин, метиндол и т.д.; колхицин, кортикостероиды. При сильных болях возможно внутрисуставное введение 25—100 мг преднизолона.
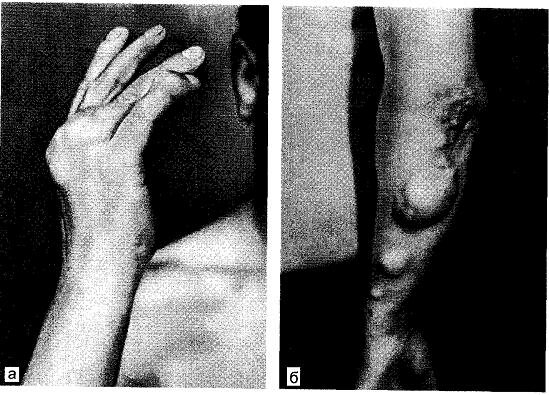
Рис. 9.1. Подагра. Поражение кисти и предплечья (а, б).
Гидроксиапатитная артропатия
Кристаллы гидроксиапатита откладываются в периартикулярные ткани сухожильные влагалища, сухожилия, соединительнотканные футляры' окружающие нервы и сосудистые пучки (рис. 9.2). У больного с поражением на протяжении бедра и голени образовалась стойкая сгибательная контрактура в коленном суставе; попытки устранить контрактуру при помощи растяжения аппаратом Илизарова в трех лечебных учреждениях кончились неудачей, так как растяжение вызывало непереносимую боль (седалищный нерв!). Мы устранили контрактуру, выполнив больному операцию — метаплазию по P.P. Вредену.
Отмечено семейное предрасположение к этому заболеванию Обнаружены антигены гистосовместимости HLA А2 и HLA A B35. Патогенез в деталях изучен недостаточно. Клиника хорошо известна врачам: наиболее часто поражаются плечевой сустав, локтевой (картина эпикондилита), суставы пальцев кисти; синдром карпального канала и т.д.
Пирофосфатная артропатия
Пирофосфатная артропатия — заболевание, которое в 90 % случаев носит семейный характер. Как показали D.McCarty, N. Kohn и J Falzes (1962), множественные отложения в периартикулярные ткани, синовиальную оболочку и суставную жидкость, матрикс суставного хряща являются кристаллами пирофосфата кальция. Заболевание характерно для пожилых людей; у молодых людей оно встречается сравнительно редко.
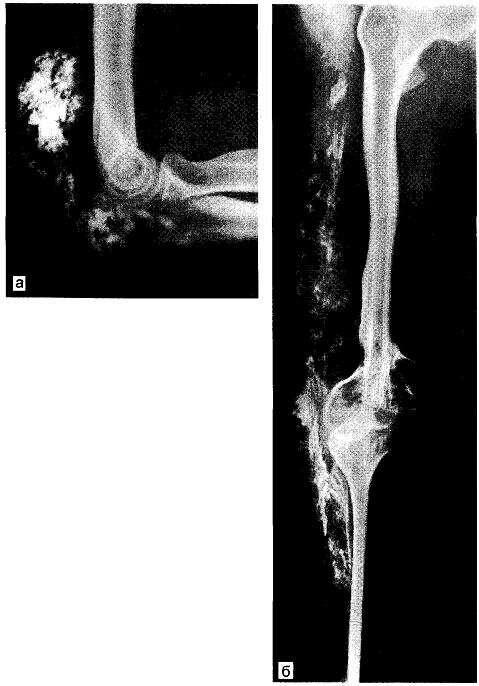
Рис. 9.2. Кальциноз околосуставных тканей области левого локтевого сустава (а), соединительнотканного влагалища бедра и голени (б).
Заболевание протекает в виде острых и подострых артропатий. На рентгенограммах обнаруживается обызвествление суставного гиалинового хряща — симптом двойного контура суставной поверхности, обызвествление менисков. Оссификаты встречаются в периартикулярных тканях, мелких суставах запястья. По данным М.Г. Астапенко (1989), при поражении тазобедренного сустава часто наблюдается обызвествление симфиза с более плотной линией посередине. При поражении позвоночника может обызвествляться весь диск или только фиброзное кольцо.
Лечение: патогенетического лечения нет. Назначают стекловидное тело, алоэ, румалон, радоновые, сероводородные ванны. При грубых деформациях — ортопедическое и хирургическое лечение.
Алкаптонурия и охронотическая артропатия
Алкаптонурия — редкое, возможно, даже редчайшее наследственное (семейное) заболевание. Гомогентизиновая кислота (ГГК) — интермедиат в метаболизме тирозина — окисляется в малеилацетоуксусную кислоту в реакции, катализируемой железо[Ре (П)]содержащей гомогентизат-1,2-диоксигеназой. Это наследственное заболевание, при котором ген, ответственный за синтез данной оксигеназы, дефектен. В результате ГГК выделяется с мочой и при добавлении щелочи окисляется с образованием 1,4-бензохинон-2-уксусной кислоты и продуктов ее полимеризации, что сопровождается характерным потемнением мочи на воздухе. Заболевание имеет несколько названий: алькаптонурия, гомогентизурия, охроноз. В норме ГГК в моче не обнаруживается. Об этом заболевании стало известно благодаря Р.Вирхову. Впервые эту болезнь описал Scribonius в 1584 г., а в 1861 г. М.Волков и Е.Бауман выделили из мочи больных кристаллы гомогентизиновой кислоты. Алкаптонурия как семейно-наследственное заболевание распространена главным образом в Чехии и Словакии; чаще поражает мужчин. Частота заболевания составляет 0,01 % на 10 000 населения. В 1925 г. P.Pieter описал семью, 13 членов которой в четырех исследованных поколениях страдали алкаптонурией (цит. по: Астапенко М.Г., 1989).
Пигмент откладывается у больных во всех тканях, но с разной интенсивностью, наиболее интенсивно — в коже под мышками, в паху, хрящевой ткани: хрящи ушных раковин, суставной хрящ всех суставов (отсюда полиартрикулярное поражение), хрящевые элементы межпозвоночных дисков, суставов, связочного аппарата, склера глаз. Эти ткани меняют свою окраску, приобретая темный, темно-зеленоватый цвет, на что обратили внимание Р.Вирхов и другие врачи. Иногда достаточно внешнего осмотра больного, чтобы поставить диагноз; можно тщательно рассматривать рентгеновские снимки, причем если временно забыть об этой болезни, то можно долго гадать, что это такое.
С.А.Рейберг в 1964 г. писал, что рентгенологическая картина при алкаптонурическом остеоартрозе ничем не отличается от обычной картины обезображивающего остеоартроза, она лишена специфических черт. Характер и выраженность изменений связаны с интенсивностью заболевания, возрастом больного. Следует, однако, помнить, что наблюдаются полиартрикулярные изменения, поражение позвоночника на всем протяжении. Хрящевые ткани, в которые отложился пигмент, теряют свою прочность, способность выносить нагрузку: наблюдаются сужение суставных щелей, резкая деформация суставных поверхностей, иногда обезображивающая суставы (особенно коленные), костные разрастания по краям хрящевых покрытий, субхондральный склероз эпифизов.
Изменения в позвоночнике многочисленны: спондилоартроз, сужение межпозвоночных дисков и частичное обызвествление их, обызвествление продольных связок и заднего связочного аппарата. Выраженное ограничение подвижности в суставах и позвоночнике вызывает постепенно усиливающиеся, нарастающие боли и в покое, и при движениях, больные не могут найти удобного положения в постели, нарушается сон. При выраженных изменениях перед нами жестоко страдающий больной. Изменения, видимые на рентгенограммах, иногда напоминают таковые при болезни Бехтерева. Мы наблюдали 3 больных с этим заболеванием. Это были мужчины от 37 до 48 лет с далеко зашедшим заболеванием, страдающие от болей, с длительным анамнезом, обращавшиеся в большое количество лечебных учреждений, где им ставили разнообразные диагнозы, в том числе и деформирующего полиартроза, но правильный диагноз был установлен только в ЦИТО.
А.М.Герасимовым, А.С.Захаровым и нами было проведено сложное биохимическое исследование. Суточную мочу больного алкаптонурией собирали во вместимости из темного стекла с 10 мл ледяной уксусной кислоты под слой (0,5 см) вазелинового масла для предотвращения контакта гомогентизиновой кислоты (ГГК) с кислородом воздуха. Количество ГТК в моче определяли по предложенному ранее методу. В суточной моче больных алкаптонурией концентрация ГГК составила не менее 4,8 гхл~', тогда как у доноров она не обнаруживалась. При такой концентрации ГГК легко идентифицировалась даже при разведении в 500 раз по спектру поглощения с максимумом при 290 нм.
Инкубация содержащей ГГК мочи в слабощелочной среде приводила к уменьшению максимума при 290 нм, которое сопровождалось появлением и увеличением максимума при 250 нм, являщегося характерным для 1,4-бензохинон-2-уксусной кислоты — продукта неферментативного окисления ГГК. Защелачивание среды инкубации увеличивало скорость окисления ГГК, оцениваемую по изменению оптической плотности при 290 нм. Этанол, супероксиддисмутаза (СОД) и дегидроаскорбиновая кислота не оказывали эффекта, тогда как аскорбиновая кислота и кверцетин ингибировали скорость окисления ГГК на 50 %, а восстановленный глутатион, цистамин — на 40 % и 30 % соответственно. В целом эти данные указывают на свободнорадикальный механизм процесса, протекающего без участия гидроксильного (неэффективность этанола) и супероксидного (неэффективность СОД) радикалов. Полное ингибирование окисления ГГК в исследуемой системе было достигнуто при концентрации ЭДТА 1хЮ" 3 М, что свидетельствует о вовлечении в реакцию свободных ионов металлов.
Уменьшение оптической плотности при 290 нм, сочетающееся с ее повышением при 250 нм, при защелачивании среды и предупреждение этих изменений при добавлении ЭДТА могут быть использованы как быстрый, чувствительный и не требующий специальных реагентов метод идентификации и количественного определения ГГК в моче.
Известно, что окисление гидрохинонов до хинонов протекает с образованием свободных радикалов семихинонов. Последние могут принимать участие в свободнорадикальных реакциях, в том числе в переносе электрона на молекулярный кислород с образованием Oj. Чтобы обнаружить появление O~i при окислении ГГК, содержащейся в моче, мы использовали СОДзависимое восстановление цитохрома с в качестве системы индикации Оj. Таким образом, при наличии кислорода, ионов металлов переменной валентности и щелочной среды происходит окисление ГГК по свободнорадикальному механизму с образованием семихинонов и Oj. Процесс удается смоделировать при использовании мочи больных алкаптонурией, что указывает на свободнорадикальный характер механизма возникновения ведущего симптома заболевания — потемнения мочи при ее защелачивании.
Основным механизмом патологии суставов, хрящей, сосудов при алкаптонурии является связывание полимерных продуктов окисления ГГК с коллагеном. Системы генерации Оj обладают цитотоксичностью, способны вызывать повреждение сосудистой стенки, деградацию коллагена и гиалуроновой кислоты.
Естественно предположить, что опосредованная О2 или семихиноном ГГК свободнорадикальная деструкция клеток и биополимеров является одним из механизмом патогенеза "охронозных" изменений соединительнотканных структур.
Лечение больных алкаптонурией сводится к назначению больших доз аскорбиновой кислоты.
С.Т.Зацепин
Костная патология взрослых
Болезнь Кашина—Бека (уровская болезнь) впервые была описана жителем города Нерченска И.М. Юренским в 1849 г. в «Трудах вольного экономического общества» под названием «Об уродливости жителей берегов речки Урова в Восточной Сибири», затем двумя военными врачами казачьих войск Н.И. Кашиным в 1860 и 1861 гг. и Е.В. Беком и его супругой А.Н. Бек в докторской диссертации 1906 г. «К вопросу об osteoartritis deformans endemika в Забайкальской области» (отсюда и название болезни). В 1929 г. была открыта Уровская научно-исследовательская станция на источнике, вода которого оказывает благоприятное действие при этой болезни. Изучением занимались многие ученые — Ф.П. Сергиевский, В.А. Тихонов и др.
По данным ряда авторов, частота заболевания в различных местностях и в разные годы неодинакова. По сообщению В.А. Тихомирова (1976), болезнь Кашина—Бека не сокращает продолжительности жизни, но ограничивает физическую трудоспособность: «не столь важно прибавить годы к жизни, как прибавить жизнь к годам». Болезнь Кашина—Бека — эндемическое заболевание, распространенное в Амурской, Читинской областях, Монголии, некоторых областях Китая, Тибета, единичные случаи встречаются и в Средней Азии, в Европейской части России. В настоящее время общепринятой считается теория, согласно которой болезнь возникает в результате дисбаланса поступления макро- и микроэлементов с водой и пищей в определенных географических областях, имеющих особые геолого-географические особенности: близкое к почве расположение вечной мерзлоты, богатые различными минералами горные породы, по которым протекают реки, и в результате — необычное для других районов соотношение макро- и микроэлементов как в растительных, так и в животных продуктах питания сельских и городских жителей этих регионов. В последние годы исследователей интересует вопрос — индуцируется ли болезнь Кашина—Бека микотоксинами.
Болезнь обычно проявляется в детском и подростковом возрасте (5— 14 лет). Нервно-психические изменения вначале малозаметные, но иногда дети испытывают затруднения в учебе. Применяют общеукрепляющее лечение, витамины, элеутерококк, курортное лечение; хлеб, картофель, мясо и т.п. заменяют продуктами, привозимыми из других регионов.
Особенно типичными при болезни Кашина—Бека являются изменения костной системы. Больные, как правило, небольшого роста. Разные авторы разделяют болезнь на две или четыре стадии. В I стадии клинические проявления отсутствуют, однако на рентгенограммах отмечаются смазанность, бесструктурность эпифизов средних фаланг II—IV пальцев и одновременно неровность субхондральной пластинки, очаговые изменения — ниша в ногтевой фаланге I пальца или средней фаланге V пальца. Иногда — хруст в суставах или преходящие ноющие боли. Для II клинической стадии характерны ноющие тупые боли в суставах, короткопалость, хруст при движениях, особенно в суставах кистей, коленных, голеностопных. На рентгенограммах к указанным изменениям прибавляются уплощение эпифизов, зоны кистозно-лакунарной перестройки, явления деформирующего артроза, изменения в позвоночнике, легкая атрофия мышц, «утиная» походка. Стадии III—IV наблюдаются у больных старшего возраста — от 40 до 70 лет, у которых все симптомы более выражены: небольшой рост, симметричность поражения суставов, хруст при движениях, симметричные деформирующие артрозы, но без реактивного синовита.
М.Р. Елисеева и др., наблюдавшие больного с болезнью Кашина—Бека в Узбекистане, указывают, что спорадически заболевание встречается на Волге, в Пскове. Киеве, Ленинграде [Тихонов В.А., 1976; Росин И.В., 1982]. После проведенного лечения (стекловидное тело, витамины группы В, никотиновая кислота, индометацин, физиотерапия, ЛФК, массаж) отмечено улучшение.
А.В. Ващенко, К.Р. Седов, В.Н. Иванов (1988) провели ряд исследований, которые позволили установить: «... в Читинской области имеется провинция с недостаточностью селена (Улетовский район), где болезнь Кашина—Бека никогда не была зарегистрирована»; «в районах эндемии болезни Кашина—Бека содержание селена в почве, растениях, продуктах питания не понижено». Авторами проведены исследования 1520 образцов горных пород в районе эндемии с анализом 46 элементов; выявлено лишь повышенное содержание фосфата и марганца. Эта же закономерность обнаружена в почвах. По их мнению, накоплению марганца и фосфора способствуют близко расположенная к поверхности многолетняя мерзлота и болотистая местность. Это препятствует оттоку почвенных коллоидов. Авторы установили, что уровень кальция в горных породах, почве и водах эндемичных районов практически не отличался от его уровня в контрольных местностях. В почвах районов, эндемичных по болезни Кашина—Бека, было также выявлено повышенное содержание полифосфатов, причем существовала прямая зависимость их содержания от степени пораженности эндемией. Согласно исследованиям авторов, содержание макрои микроэлементов в продуктах питания и травах было нормальным. Содержание фосфора в пшенице в районе эндемии составило 5470±72,7 мг/кг, тогда как в контрольном — лишь 3324±79,8 мг/кг; в картофеле соответственно— 882,3±6,3 и 380,0±6,02 мг/кг. Достоверно повышенным было также содержание неорганического фосфора в сыворотке и марганца — в цельной крови. Уровень кальция был нормальным. Выделение с мочой неорганического фосфора и марганца — повышено.
Данные, полученные А.В. Ващенко и др., весьма убедительны. На основании своих исследований авторы выдвинули фосфатно-марганцевую гипотезу происхождения болезни Кашина—Бека. В различные ее стадии изучаемые показатели меняются, а избыточное поступление фосфора способствует гиперфосфатемии, гиперфосфатурии, гипокальциемии, что вызывает реакцию со стороны околощитовидных желез: повышение выработки паратгормона приводит к остеопорозу. Однако в заключение авторы подчеркивают, что патогенез болезни Кашина—Бека очень сложный и его нельзя свести только к изменению содержания фосфатов и марганца в организме.
И.В. Росин (1995) обследовал 20 больных, страдающих болезнью Кашина—Бека, в возрасте от 40 до 66 лет. В суточной моче определялась экскреция гликозаминогликанов — 10,7+0,12 мг/сут, гиалуроновой кислоты — 5,6±0,28 мг/сут, хондроитинсульфатов — 5,12±0,32 мг/сут. После лечения трилоном Б в виде фенофореза уменьшились боли в суставах, увеличился объем движений. Содержание гликозаминогликанов повысилось до 11,83±0,21 мг/сут (норма 21,15±0,14 мг/сут), снизился уровень гиалуроновой кислоты — 3,66+0,41 мг/сут (норма — 1,85+0,02 мг/сут), повысилась концентрация хондроитинсульфатов — 8,17+0,76 мг/сут (норма — 19,30+0,16 мг/сут). Автор считает перспективным поиск более эффективных комплексонов для лечения.
По его же данным, уровень гликозаминогликанов в моче больных во II стадии заболевания был достоверно понижен в сравнении с уровнем у здоровых людей (3,61±0,13 и 12,99±1,6 мг/сут). Было отмечено повышение экскреции с мочой гиалуроновой кислоты, гепарина, снижение хондроитинсульфатов. Количество фруктозы в сыворотке крови достоверно повышалось, содержание сиаловой кислоты снижалось, а уровень общих гексоз несущественно увеличивался, концентрация сиаловой кислоты и общих гексоз понижалась несущественно.
Эти и другие исследования и их трактовка дают основание считать, что все процессы, происходящие в организме при болезни Кашина—Бека, усиливают развитие склеротических и фибротических процессов в хряще и кости, нарушая остеогенез — раннее синостозирование эпифиза и метафиза с образованием брахифалангии.
По мнению А.П. Иено (1974), все это происходит, очевидно, в результате торможения синтеза коллагена II и I типов хряща и кости вследствие ингибирования железом активности ферментов гидроксилирования пролина и лизина, а также недостаточного поступления в организм аскорбиновой кислоты. М.А. Риш (1989) указывает на тормозящее действие цинка, что вызывает уменьшение активности проколлагенпептазы, а Ю.И. Москалев (1985) приписывает тормозящее действие и марганцу. Перечисленные выше изменения приводят, как считает А.А. Дельвиг (1966), к образованию атипичных структур коллагена, нарушению формирования конечных связей в фибриллах. По данным В.П. Торбенко и Б.С. Касавиной (1977), снижение экскреции с мочой фукозы и сиаловой кислоты является результатом уменьшения синтеза сиалопротеина костной ткани, в связи с чем нарушается ее способность связывать катионы.
Из известных ПО элементов периодической системы Д.И. Менделеева в организме животных и человека находится не менее 86—88, причем биологическое действие установлено у 67 из них. Считают, что 12 элементов жизненно необходимы. По мнению В.М. Мищенко и соавт. (1973), в нормальном росте кости и при патологических изменениях в ней принимают участие не менее 30—40 микроэлементов. В эндемичных очагах болезни Кашина—Бека в организме наблюдается избыток стронция, бария, молибдена, цинка, бериллия, железа, свинца, серебра и недостаток кальция, магния, меди, никеля, кобальта. Такой дисбаланс микроэлементов, наблюдаемый в этих районах, естественно, нарушает процессы костеобразования в метафизарных зонах роста костей, закладку и формирование коллагеновых структур, протеогликанов, процессы минерализации и оссификации хряща. В. Truban, С. Balcik, N. Akkas (1997) в эксперименте показали:
«...Оба состояния — снижение или избыток селена в пище (нехватка витамина Е в пище) — обладали грубым эффектом на механические свойства костной ткани».
Модули эластичности исследуемых трех групп экспериментальных животных были на 15—30 % ниже контрольных значений. Исследование костной ткани под световым микроскопом показало, что изменения похожи на остеомаляцию.
И.В. Росин (1994) предполагает, что происходит ингибирование марганцем активности ферментов, участвующих в синтезе предшественников хондроитинсульфатов и кератосульфата.
Л.П. Никитина и соавт. (1981) сообщили об угнетении биологического окисления с переключением на анаэробный путь распада глюкозы. Есть указания на снижение скорости образования белка. И.В. Росин (1994) также отметил снижение содержания белково-связанного оксипролина в плазме крови и общего оксипролина в моче.
Болезнь Кешана — беломышечная болезнь
В настоящее время установлено, что недостаточное содержание селена в почве, воде, продуктах питания приводит к развитого болезни Кешана (впервые описанную в Китае в 1935 г. в округе Кешан), известной также под названием беломышечной болезни. Болезнь характеризуется нарушением обмена веществ, дегенеративными изменениями в скелетных мышцах, изменениями в сердце и других органах. Описаны различные формы этой болезни. Поскольку болезнь Кешана мало известна в нашей стране, а ее патогенез прямо связан с содержанием в крови селена, мы сочли необходимым привести краткую справку о ней.
К.Р. Седов, В.Н. Иванов, А.В. Бащенко и др. (1988) посвятили статью болезни Кешана (беломышечная болезнь), которая распространена среди животных и людей в Забайкалье. В крови животных уровень селена снижен в 3—10 раз, в крови людей — в 2—4 раза (по данным авторов, 20—60 мкг/л). Зимой 1935 г. болезнь была описана в округе Кешан в Китае, а затем она была диагностирована и в других районах Китая. Это заболевание может возникнуть у людей, переселившихся в район, где это заболевание эндемично, при этом заболевание проявлялось на севере Китая чаще зимой, на юге — летом. Формы течения болезни разнообразные — от латентного с общими симптомами до остро наступившей одышки, падения артериального давления с выраженной картиной сердечной недостаточности, поперечной блокады сердца и т.п. Патологоанатомы обнаруживают очаги перерождения миокарда, скелетных мышц, диафрагмы, которые дряблы, бледно-желтого цвета, а местами имеют беловатый цвет или вид белых пятен на участках лентовидной формы.
К.Р. Седов и соавт. (1988) обследовали более 1000 жителей селенодефицитного Улетовского района в Забайкалье. Они обнаружили, что у здоровых людей содержание селена составило 96 мкг/л, у детей — 84 мкг/л, тогда как у взрослых больных с выявленной кардиопатией содержание селена в крови было 30 мкг/л, у детей — 27 мкг/л. Они установили, что содержание селена в питьевой слабоминерализованной воде меньше 1 мкг/л, в коровьем молоке — ниже нормы в 8—20 раз, в мясе — в 3—12 раз, картофеле — в 3—9 раз. По расчетам авторов, суточное потребление селена у больных было в 2,5—4 раза меньше нормы. Они считают необходимым проводить в этих районах: 1) селенизацию продуктов местного производства; 2) назначать препараты, восполняющие функцию селена в организме (например, витамина Е); 3) применять препараты, улучшающие всасывание селена (соляная, аскорбиновая кислоты, желчегонные средства).
Некоторые метаболические артриты-периартриты
Подагра
В результате повышения в крови уровня мочевой кислоты в тканях откладываются в виде кристаллов ураты — натриевая соль мочевой кислоты. Мочевая кислота образуется в результате расщепления пуринов, в большом количестве содержащихся в мясе и рыбе. Отрицательное влияние оказывает регулярное употребление алкоголя, вина. В крови может возникнуть гиперуремия, если урат натрия (мочевая кислота) недостаточно выводится из организма почками. Верхняя граница содержания урата натрия в крови для мужчин 0,42 ммоль/л, для женщин — 0,36 ммоль/л. Подагра, очевидно, связана с нарушениями нескольких генов, поскольку образование мочевой кислоты — многоступенчатый биохимический процесс, проявления нарушений которого определяются у нескольких членов семьи, чаще у мужчин.
Известно несколько типов клинического течения подагры.
1. Постепенное, незаметное отложение микрокристаллов уратов натрия в соединительнотканных образованиях в окружности суставов, суставной сумке, менисках коленных суставов, под кожей с формированием округлой формы образований микро- и макротофусов, иногда достигающих в диаметре несколько сантиметров (рис. 9.1). У некоторых больных мочекислые соли вызывают узурацию кости, что иногда приводит к перелому кости; чаще эти скопления можно удалить хирургическим путем, у других требуется резекция кости на протяжении или ампутация II—III фаланги пальца, поскольку чаще поражаются стопы и кисти рук.
2. Острые приступы подагры возникают у большинства больных периодически, в периоды нарушения выведения мочевой кислоты почками после многодневного запоя, когда, как правило, у больных нарушается аппетит. Алкоголь способствует увеличению концентрации мочевой кислоты, а голодание — увеличению кетоновых кислот. К сожалению, острые приступы подагры периодически наблюдаются и у больных, соблюдающих строжайшую диету. Острый приступ характеризуется внезапно (часто ночью) возникающими сильнейшими болями в области пораженного сустава, увеличением припухлости, покраснением кожи и быстрым подъемом температуры тела, иногда до 40 °С; нарастают лейкоцитоз, СОЭ. Острая воспалительная реакция синовиальной оболочки, всего тофуса, располагающегося параартикулярно, обусловлена, по данным D.MacCarty и J. Hollender (1961), образованием и выпадением в полость сустава микрокристаллов урата натрия. Нередко кожа над тофусом истончается и образуется свищ, через который выделяется конгломерат мочевой кислоты; лечение хирургическое. Мы не видели ни одного больного с подагрой с 1941 по 1950 г., когда в России был жестокий голод.
3. Поражение почек у больного подагрой. Мочевая кислота, которая выводится почками, вызывает так называемую подагрическую почку: интерстициальный нефрит, гломерулосклероз и артериосклероз, т.е. нефросклероз, уратные камни, тофусы в паренхиме почки — все это способствует развитию почечной недостаточности и у значительного процента больных (до 40—45 %) ведет к смерти.
Лечение. Основное условие — соблюдение диеты: ограничение или отказ от мяса, рыбы, алкоголя и т.д. Назначают пиразолоновые препараты — бутадиен, реопирин, кетазон, фенилбутазон и т.д., а также препараты индольного ряда: индоцид, индометацин, метиндол и т.д.; колхицин, кортикостероиды. При сильных болях возможно внутрисуставное введение 25—100 мг преднизолона.

Рис. 9.1. Подагра. Поражение кисти и предплечья (а, б).
Гидроксиапатитная артропатия
Кристаллы гидроксиапатита откладываются в периартикулярные ткани сухожильные влагалища, сухожилия, соединительнотканные футляры' окружающие нервы и сосудистые пучки (рис. 9.2). У больного с поражением на протяжении бедра и голени образовалась стойкая сгибательная контрактура в коленном суставе; попытки устранить контрактуру при помощи растяжения аппаратом Илизарова в трех лечебных учреждениях кончились неудачей, так как растяжение вызывало непереносимую боль (седалищный нерв!). Мы устранили контрактуру, выполнив больному операцию — метаплазию по P.P. Вредену.
Отмечено семейное предрасположение к этому заболеванию Обнаружены антигены гистосовместимости HLA А2 и HLA A B35. Патогенез в деталях изучен недостаточно. Клиника хорошо известна врачам: наиболее часто поражаются плечевой сустав, локтевой (картина эпикондилита), суставы пальцев кисти; синдром карпального канала и т.д.
Пирофосфатная артропатия
Пирофосфатная артропатия — заболевание, которое в 90 % случаев носит семейный характер. Как показали D.McCarty, N. Kohn и J Falzes (1962), множественные отложения в периартикулярные ткани, синовиальную оболочку и суставную жидкость, матрикс суставного хряща являются кристаллами пирофосфата кальция. Заболевание характерно для пожилых людей; у молодых людей оно встречается сравнительно редко.

Рис. 9.2. Кальциноз околосуставных тканей области левого локтевого сустава (а), соединительнотканного влагалища бедра и голени (б).
Заболевание протекает в виде острых и подострых артропатий. На рентгенограммах обнаруживается обызвествление суставного гиалинового хряща — симптом двойного контура суставной поверхности, обызвествление менисков. Оссификаты встречаются в периартикулярных тканях, мелких суставах запястья. По данным М.Г. Астапенко (1989), при поражении тазобедренного сустава часто наблюдается обызвествление симфиза с более плотной линией посередине. При поражении позвоночника может обызвествляться весь диск или только фиброзное кольцо.
Лечение: патогенетического лечения нет. Назначают стекловидное тело, алоэ, румалон, радоновые, сероводородные ванны. При грубых деформациях — ортопедическое и хирургическое лечение.
Алкаптонурия и охронотическая артропатия
Алкаптонурия — редкое, возможно, даже редчайшее наследственное (семейное) заболевание. Гомогентизиновая кислота (ГГК) — интермедиат в метаболизме тирозина — окисляется в малеилацетоуксусную кислоту в реакции, катализируемой железо[Ре (П)]содержащей гомогентизат-1,2-диоксигеназой. Это наследственное заболевание, при котором ген, ответственный за синтез данной оксигеназы, дефектен. В результате ГГК выделяется с мочой и при добавлении щелочи окисляется с образованием 1,4-бензохинон-2-уксусной кислоты и продуктов ее полимеризации, что сопровождается характерным потемнением мочи на воздухе. Заболевание имеет несколько названий: алькаптонурия, гомогентизурия, охроноз. В норме ГГК в моче не обнаруживается. Об этом заболевании стало известно благодаря Р.Вирхову. Впервые эту болезнь описал Scribonius в 1584 г., а в 1861 г. М.Волков и Е.Бауман выделили из мочи больных кристаллы гомогентизиновой кислоты. Алкаптонурия как семейно-наследственное заболевание распространена главным образом в Чехии и Словакии; чаще поражает мужчин. Частота заболевания составляет 0,01 % на 10 000 населения. В 1925 г. P.Pieter описал семью, 13 членов которой в четырех исследованных поколениях страдали алкаптонурией (цит. по: Астапенко М.Г., 1989).
Пигмент откладывается у больных во всех тканях, но с разной интенсивностью, наиболее интенсивно — в коже под мышками, в паху, хрящевой ткани: хрящи ушных раковин, суставной хрящ всех суставов (отсюда полиартрикулярное поражение), хрящевые элементы межпозвоночных дисков, суставов, связочного аппарата, склера глаз. Эти ткани меняют свою окраску, приобретая темный, темно-зеленоватый цвет, на что обратили внимание Р.Вирхов и другие врачи. Иногда достаточно внешнего осмотра больного, чтобы поставить диагноз; можно тщательно рассматривать рентгеновские снимки, причем если временно забыть об этой болезни, то можно долго гадать, что это такое.
С.А.Рейберг в 1964 г. писал, что рентгенологическая картина при алкаптонурическом остеоартрозе ничем не отличается от обычной картины обезображивающего остеоартроза, она лишена специфических черт. Характер и выраженность изменений связаны с интенсивностью заболевания, возрастом больного. Следует, однако, помнить, что наблюдаются полиартрикулярные изменения, поражение позвоночника на всем протяжении. Хрящевые ткани, в которые отложился пигмент, теряют свою прочность, способность выносить нагрузку: наблюдаются сужение суставных щелей, резкая деформация суставных поверхностей, иногда обезображивающая суставы (особенно коленные), костные разрастания по краям хрящевых покрытий, субхондральный склероз эпифизов.
Изменения в позвоночнике многочисленны: спондилоартроз, сужение межпозвоночных дисков и частичное обызвествление их, обызвествление продольных связок и заднего связочного аппарата. Выраженное ограничение подвижности в суставах и позвоночнике вызывает постепенно усиливающиеся, нарастающие боли и в покое, и при движениях, больные не могут найти удобного положения в постели, нарушается сон. При выраженных изменениях перед нами жестоко страдающий больной. Изменения, видимые на рентгенограммах, иногда напоминают таковые при болезни Бехтерева. Мы наблюдали 3 больных с этим заболеванием. Это были мужчины от 37 до 48 лет с далеко зашедшим заболеванием, страдающие от болей, с длительным анамнезом, обращавшиеся в большое количество лечебных учреждений, где им ставили разнообразные диагнозы, в том числе и деформирующего полиартроза, но правильный диагноз был установлен только в ЦИТО.
А.М.Герасимовым, А.С.Захаровым и нами было проведено сложное биохимическое исследование. Суточную мочу больного алкаптонурией собирали во вместимости из темного стекла с 10 мл ледяной уксусной кислоты под слой (0,5 см) вазелинового масла для предотвращения контакта гомогентизиновой кислоты (ГГК) с кислородом воздуха. Количество ГТК в моче определяли по предложенному ранее методу. В суточной моче больных алкаптонурией концентрация ГГК составила не менее 4,8 гхл~', тогда как у доноров она не обнаруживалась. При такой концентрации ГГК легко идентифицировалась даже при разведении в 500 раз по спектру поглощения с максимумом при 290 нм.
Инкубация содержащей ГГК мочи в слабощелочной среде приводила к уменьшению максимума при 290 нм, которое сопровождалось появлением и увеличением максимума при 250 нм, являщегося характерным для 1,4-бензохинон-2-уксусной кислоты — продукта неферментативного окисления ГГК. Защелачивание среды инкубации увеличивало скорость окисления ГГК, оцениваемую по изменению оптической плотности при 290 нм. Этанол, супероксиддисмутаза (СОД) и дегидроаскорбиновая кислота не оказывали эффекта, тогда как аскорбиновая кислота и кверцетин ингибировали скорость окисления ГГК на 50 %, а восстановленный глутатион, цистамин — на 40 % и 30 % соответственно. В целом эти данные указывают на свободнорадикальный механизм процесса, протекающего без участия гидроксильного (неэффективность этанола) и супероксидного (неэффективность СОД) радикалов. Полное ингибирование окисления ГГК в исследуемой системе было достигнуто при концентрации ЭДТА 1хЮ" 3 М, что свидетельствует о вовлечении в реакцию свободных ионов металлов.
Уменьшение оптической плотности при 290 нм, сочетающееся с ее повышением при 250 нм, при защелачивании среды и предупреждение этих изменений при добавлении ЭДТА могут быть использованы как быстрый, чувствительный и не требующий специальных реагентов метод идентификации и количественного определения ГГК в моче.
Известно, что окисление гидрохинонов до хинонов протекает с образованием свободных радикалов семихинонов. Последние могут принимать участие в свободнорадикальных реакциях, в том числе в переносе электрона на молекулярный кислород с образованием Oj. Чтобы обнаружить появление O~i при окислении ГГК, содержащейся в моче, мы использовали СОДзависимое восстановление цитохрома с в качестве системы индикации Оj. Таким образом, при наличии кислорода, ионов металлов переменной валентности и щелочной среды происходит окисление ГГК по свободнорадикальному механизму с образованием семихинонов и Oj. Процесс удается смоделировать при использовании мочи больных алкаптонурией, что указывает на свободнорадикальный характер механизма возникновения ведущего симптома заболевания — потемнения мочи при ее защелачивании.
Основным механизмом патологии суставов, хрящей, сосудов при алкаптонурии является связывание полимерных продуктов окисления ГГК с коллагеном. Системы генерации Оj обладают цитотоксичностью, способны вызывать повреждение сосудистой стенки, деградацию коллагена и гиалуроновой кислоты.
Естественно предположить, что опосредованная О2 или семихиноном ГГК свободнорадикальная деструкция клеток и биополимеров является одним из механизмом патогенеза "охронозных" изменений соединительнотканных структур.
Лечение больных алкаптонурией сводится к назначению больших доз аскорбиновой кислоты.
С.Т.Зацепин
Костная патология взрослых
Комментировать:
Похожие статьи:
Удаление гигантских доброкачественных и некоторых злокачественных опухолей крестца
Категории: Костная патология, Лечение при опухолях костей,
Доброкачественные опухоли крестца, особенно неврогенного происхождения — неврилеммомы, нейрофибромы, достигают иногда очень больших, даже гигантских размеров. Они смещают кверху и деформируют мочевой..
Удаление опухолей крестца
Категории: Костная патология, Лечение при опухолях костей,
Рис. 43.14. Тератома крестца. а разрушены III, IV, V крестцовые позвонки — тератома удалена. Метастазы рака в крестце выявлены у 72 пациентов (или 8 %) из 908 оперированных с метастатическими..
Редкие обменные заболевания костей
Категории: Костная патология, Метаболические заболевания костей,
Болезнь Кашина—Бека Болезнь Кашина—Бека (уровская болезнь) впервые была описана жителем города Нерченска И.М. Юренским в 1849 г. в «Трудах вольного экономического общества» под названием «Об уродливости..
Некоторые формы акроостеолиза и самопроизвольное исчезновение костей
Категории: Костная патология, Метаболические заболевания костей,
Работами большого числа исследователей было показано, что существует целый ряд заболеваний, обусловленных врожденным дефектом какого-то гена — «первичный молекулярный дефект». Это выявляется как нарушение..

