Учебные материалы
Конектбиофарм
Работа
Компании
Реклама от Google
Остеогенная саркома
Категории: Костная патология, Дисплазии и опухоли костей,
Остеогенная саркома — очень злокачественная опухоль. По частоте возникновения занимает первое место, составляя, по данным D.C.Dahlin (1967), наблюдавшего 650 больных с остеогенной саркомой, 39 % всех больных с саркомами. Из 650 больных с остеогенной саркомой у 20 она возникла в костях, пораженных болезнью Педжета, у 2 — фибросаркомой и у 1 больного — гигантоклеточной опухолью. Чаще она встречалась у лиц мужского пола (62 %).
По данным ВОНЦ АМН РФ, с 1952 по 1985 г. лечилось 350 больных с остеогенной саркомой, что составило 38,3 % больных с саркомой костей.
В 1922 г. J.Ewing предложил называть саркомы, происходящие из костных клеток, «остеогенными саркомами», следовательно, в эту группу опухолей входили и паростальная саркома, и хондросаркома. Последующими исследователями был внесен целый ряд уточнений [Виноградова Т.П., 1973; Kolodny А., 1927; Phemister D.W., 1930; Geschickter C.F., Copeland M.M., 1951], в результате чего пришли к единому мнению, выраженному в международной гистологической классификации костных опухолей 1974 г.: остеосаркома, остеогенная саркома — это злокачественная опухоль, характеризующаяся непосредственным образованием кости или остеоида опухолевыми клетками. Обнаружение в клетках опухоли щелочной фосфатазы с помощью гистохимического исследования может помочь проведению дифференциальной диагностики.
Т.П.Виноградова (1973) особенно подчеркивала, что хотя и принят термин «остеогенная саркома» (происходящая из костеобразующей ткани), ее правильнее было бы называть «остеогенетической саркомой», т.е. образующей костную ткань; следовательно, правомочен также термин «остеопластическая» независимо от того, имеется ли остеопоротическая или остеосклеротическая форма. Т.П.Виноградова принципиально возражала и против употребления широко распространенного названия «остеосаркома», считая его собирательным, неточным.
Остеогенная саркома, как правило, возникает в одной кости, но описаны и множественные поражения костей, а также возникновение остеогенной саркомы у 2 сестер и брата практически в одно и то же время [Roberts C.W., Roberts С.P., 1935]. Предположение, что остеогенная саркома возникает из мультипотентных мезенхимальных клеток, подтверждается, по нашему мнению, тем фактом, что описаны больные с внескелетными остеогенными саркомами, развивающимися в мыщцах, матке, почках, щитовидной железе, молочной железе и других тканях, причем опухоли не связаны с рядом расположенными костями. О внескелетных остеогенных саркомах упоминает и Т.П.Виноградова (1973). R.Lorentzon и соавт. (1979) сообщили о 4 больных, из которых в течение 2 лет умерли трое и один жив 14 лет. По данным этих авторов, в 1978 г. в англоязычной литературе описано 107 больных с внекостной остеогенной саркомой, средний возраст которых составил 51 год. Рецидивы опухоли возникают как правило, поэтому необходимы широкие резекции с соблюдением принципа зональности и футлярности, а также современная полихимиотерапия.
R.I.Ferguson, E.I.Junis (1978) на основании электронно-микроскопического изучения остеогенных сарком идентифицирует следующие типы клеток: примитивные недифференцированные мезенхимальные клетки и клетки с морфологическими признаками остеобластов, хондробластов и фибробластов в сочетании с многоядерными клетками, часть из которых подобны остеокластам, тогда как в других клетках имеются анапластические и дегенеративные изменения. Авторы полагают, что эти примитивные мезенхимальные клетки являются плюрипотенциальными клетками, способными дифференцироваться в различные клетки. К подобным выводам пришли Л.В.Литвинова (1976), D.Katenkamp и др. (1978), E.Grundmako и соавт. (1981). A.Roessner и соавт. к указанным видам клеток прибавили клетки ангиогенной природы и миофибробластической дифференцировки.
В.Ф.Кондаленко и др. (1987) при электронно-микроскопическом исследовании остеогенных и паростальных сарком обнаружили различия во внеклеточном матриксе, в частности протеогликанов. Они считают, что отличие в структуре протеогликанов обусловливает направление и уровень дифференцировки клеток опухоли, что и определяет степень злокачественности опухоли. Так, они обнаружили резкое отличие в структуре протеогликанов в матриксе паростальной и остеогенной сарком, которые клинически резко различаются в своей злокачественности.
Электронно-микроскопические данные свидетельствуют о том, что остеогенная саркома, как и другие виды опухолей, может происходить из примитивных недифференцированных мезенхимальных клеток, прямо связанных с рядом биохимических процессов; некоторые из них приведены ниже.
В опухолевых клетках тканеспецифические белки отсутствуют или их очень мало, как и ферментов, характерных для нормальных тканей. На этом основании считают, что предшественниками опухолевых клеток являются низкодифференцированные клетки [Potter V.R., 1969, и др.] или возникновение злокачественных опухолей (клеток) связано с процессом недифференцировки, или ретродифференцировки, — процессом, который предшествует появлению опухолевых клеток [Оленев Ю.М., 1977; Uriel J., 1979; Curtin N.J., Snell К., 1983].
Прямое участие в развитии опухолевых клеток принимают ферменты, которые подразделяют на две группы: 1) ферменты, обеспечивающие процесс пролиферации, и 2) ферменты, включенные в системы передачи в клетку регуляторных сигналов извне, т.е. осуществляющие регуляцию пролиферации [Ходостова И.А., 1988].
Длительное время как о чем-то таинственном говорилось об автономности опухолевого роста. Эта особенность присуща опухолевым клеткам и определяет их свойства, но необъяснима. В последние годы было показано, что некоторые протеинкиназы находятся в связи с рецепторами факторов роста, а системы циклических нуклеотидов и ферментов их метаболизма приобретают важное значение в делении клеток нормальных тканей. Было обнаружено также, и это особенно важно, что в опухолевых тканях имеются существенные отклонения характеристик ряда ферментов, участвующих в пролиферации клеток. Это и определяет их автономный рост. Так объясняется с биохимических позиций автономность роста опухоли.
И наконец, клетка обладает, с одной стороны, возможностью активировать положительные, необходимые в данное время процессы, а с другой — давать начало процессам, отрицательно отражающимся на функции всего организма или какого-либо органа, ткани. Процессы регуляции активности генов деятельности ДНК (торможение ее функции) происходят в результате сложных процессов, одним из которых является метилирование ДНК ферментами ДНК — метилазами. Химические канцерогены нарушают, изменяют, снижают процесс метилирования ДНК, в результате чего ряд генов (онкогены), кодирующих синтез белков и определяющих появление опухолевых клеток, начинают функционировать и вызывают дифференцировку примитивных недифференцированных мезенхимальных клеток в опухолевую ткань. Нужно помнить, что гены состоят из четырех нуклеотидных оснований: аденина (А), темина (Т), цитозина (Ц), гуанина (Г). Разные комбинации А, Т, Ц и Г кодируют различные белки.
Как известно, в 1960 г. была открыта согласуемая хромосомная аберрация в опухолевых клетках при хронической миеломной лейкемии, и с тех пор продолжаются исследования хромосом с точки зрения ракового цитогенеза. N.Mandahl и A.Rydholm (1989) опубликовали данные, полученные ими и другими исследователями, изучавшими изменения в хромосомах у больных со следующими опухолями костей: саркомой Юинга, остеогенной саркомой, хондромами, хондросаркомами, злокачественной фиброзной гистиоцитомой, синовиальной саркомой, липомой, липосаркомой и некоторыми другими.
При остеогенной саркоме только в незначительном числе клеток хромосомы оставались неизменными, а в большинстве клеток были обнаружены сложные изменения в наборах хромосом, наблюдались клетки как гиподиплоидные, так и приближающиеся почти до гексадиплоидного уровня, в большинстве опухолей обнаруживались участки с триплоидными и тетраплоидными клетками. Можно надеяться, что изучение хромосом злокачественных опухолей позволит лучше понять процессы, происходящие в клетках. Н.А.Краевский и Ю.Н.Соловьев (1971) описали важные наблюдения, имеющие значение в патои морфогенезе остеогенной саркомы. В теоретическом аспекте они исходили из известного положения о предшествующих опухолевому росту явлениях диспластического и дистрофического характера, согласно которому глубокие метаболические нарушения, приводящие к изменениям в клетках и тканях, влияют на их дифференцировку и являются обязательным условием возникновения опухолей. Изменения энхондрального остеогенеза непосредственно связаны с процессами кровоснабжения и особенностями метаболизма хрящевой ткани зоны роста длинных трубчатых костей, что приводит к нарушению процессов превращения хрящевой ткани в костную, а в период интенсивного роста кости может обусловить появление диспластической хрящевой ткани.
Изучение костей, пораженных остеогенной саркомой, у ряда больных в возрасте 12—18 лет позволило Н.А.Краевскому и Ю.Н.Соловьеву выявить отчетливые признаки задержки резорбции хряща и смещение участков метафизарной спонгиозы по оси в диафизарном направлении с отрывом их от эпифизарной хрящевой пластинки. Фактически подобные изменения представляют собой полный аналог зоны, или «пояска» (в известной мере эктопированного), костеобразования, которое наблюдается и при экспериментальном воспроизведении опухолей скелета. Единственным реальным объяснением этого явления может быть только трактовка его с позиции нарушения синхронности процессов костеобразования (энхондрального остеогенеза) и процесса роста кости.
Как показали исследования Ederer (1965) и J.E.Fraumani (1967), существует достоверный параллелизм между увеличением и ускорением роста в возрасте 12—17 лет и частотой возникновения остеогенной саркомы. По данным Ю.Н.Соловьева (1959), редукция сосудистого русла костей вблизи зон роста у экспериментальных животных приводит к угнетению энхондрального остеогенеза в зонах роста и персистенции хряща эпифизарных пластинок.
По сообщению Н.А.Краевского и Ю.Н.Соловьева, у 98,5 % больных остеогенная саркома возникла в длинных трубчатых костях, а у 80 % развилась в дистальном конце бедренной кости и проксимальных концах большеберцовой и малоберцовой костей, т.е. ростковых зонах, обладающих наибольшей скоростью роста. Известно, что остеогенная саркома наблюдается у пород собак высокого роста и не встречается у низкорослых собак, что нужно прямо связать со скоростью роста костей за счет эпифизарных зон.
В настоящее время морфологические данные являются основой, на которой строятся наши представления о патогенезе и развитии опухолей. Процессы, определяющие опухолевые клетки и предшествующие возникновению опухоли как таковой, известны, но не настолько детально изучены, чтобы в своей практической деятельности врачи различных специальностей могли бы улавливать момент возникновения опухоли, точную ее локализацию и направленность изменений биохимических процессов в межклеточной субстанции, которые определяют возникновение новой опухолевой популяции клеток, развивающихся из мезенхимальных клеток — клеток-предшественников, стволовых клеток. Следует считать, что опухолевые клетки возникают под влиянием воздействия многочисленных физических (малоизученных), биохимических нарушений, а также атомных, молекулярных метаболических отклонений, которые приводят к изменениям генов и нарушениям в ДНК, обусловливающим начало опухолевого роста.
Н.Н.Трапезников и соавт. (1983) указывали, что во втором десятилетии жизни возникают 80 % остеогенных сарком, при этом у мальчиков 11 — 15 лет они встречаются реже (37,5 %), чем у девочек того же возраста (62,5 %). Противоположное соотношение наблюдается в следующее пятилетие: среди мужчин 16—20 лет опухоль развивается у 62,5 %, а среди женщин того же возраста — у 37,5 %. Приведенные статистические данные с несомненностью говорят о значении эндокринных влияний, скорости роста длинных трубчатых костей в длину за счет зон роста костей, где возникает 97 % опухолей, а в 80 % опухолей развиваются в зонах с наиболее интенсивным ростом: это нижний метафиз бедренной кости, верхний метафиз плечевой кости, затем следуют кости таза, верхняя и нижняя челюсти, позвоночник, ребра, лопатка, кости предплечья, стопы, кисти, при этом определенную роль играет размер площади зоны роста. Отмечено, что у подростков, юношей, девушек высокого роста вероятность возникновения опухоли больше.
Некоторые авторы считают, что травма может способствовать началу развития опухоли, если имеется «готовность» тканей к опухолевому процессу, а по мнению других — если имеются бластоматозные клетки. Согласно нашим наблюдениям травма способствовала лишь выявлению уже существовавшего опухолевого процесса.
Клиническая картина остеогенной саркомы характерна и соответствует проявлениям быстро растущих злокачественных опухолей. Особенно характерна боль, появляющаяся раньше видимой опухоли; сильная боль отмечается днем и ночью, рано развиваются атрофия мышц, сгибательная контрактура в суставе (наиболее часто в коленном). Повышение местной температуры, истощение, усиленная сеть подкожных вен, метастазы в легких появляются позднее. У части больных все клинические проявления протекают бурно, а у другой части — они менее выражены и развитие опухоли происходит медленнее.
Рентгенологическая картина зависит от многих причин: центрального или периферического расположения очага опухоли, превалирования тех или иных гистологических структур, процессов, сопровождающих рост опухоли. Принято выделять остеолитический и остеосклеротический варианты, а также хондробластический и телеангиэктатический типы остеогенной саркомы. Согласно данным Н.Н.Трапезникова, Л.А.Ереминой, Ю.Н.Соловьева и др. менее агрессивное течение наблюдается при остеосклеротическом и хондробластическом типах и более агрессивное — при остеолитическом и телеангиэктатическом типах, однако это бывает не всегда, так как при остеосклеротическом типе возможно и очень злокачественное течение.
При остеолитическом типе наблюдаются преимущественно процессы разрушения, лизиса кости; при телеангиэктатическом типе наряду с разрушениями происходит формирование плотных костных опухолевых масс, имеющих на рентгенограммах характерный склеротический вид. Широко известны такие рентгенологические симптомы, как спикулы и периостальный козырек Кодмана. У некоторых больных эти симптомы нерезко выражены, и тогда диагностика представляет значительные трудности; ошибки в диагнозе ведут к неправильному лечению.
Сцинтиграфия является ценным диагностическим методом, позволяющим рано выявить первичный очаг и определить состояние всего скелета. Е.К.Колесникова и А.В.Забродина (1988) показали, что возможности компьютерной томографии в диагностике остеогенной саркомы очень велики, поскольку хорошо видны такие изменения кортикального слоя кости, как разрыхление, расслоение, прерывистость, а также изменения надкостницы, ее отслоение, появление спикул, хорошо виден внекостный компонент опухоли.
Гистологическое строение остеогенной саркомы весьма разнообразно. Это относится как к разным больным, так и к различным участкам опухоли. Клетки то напоминают остеобласты, то имеют округленную, веретенообразную форму. В опухолевой ткани характерно наличие большего или меньшего количества атипичных костных обызвествленных или необызвествленных остеоидных структур (Т.П.Виноградова).
Тщательно проведенные на большом материале исследования И.В.Забродиной (1995) показали, что в 9,8 % случаев метастазы остеогенной саркомы выявляются в костях при еще интактных легких. Это еще раз подтверждает нашу гипотезу, что метастазирование возникает более легко и, следовательно, чаще в тканях, которые по строению близки к ткани опухоли, когда сходно строение «географических мембран» клеток опухолей и клеток тканей.
И.В.Забродиной (1995) детально разработаны критерии ранней диагностики опухоли в зависимости от ее локализации: губчатая кость, кортикальная кость, периост. Она также описала две редкие локализации остеогенной саркомы — интракортикальную и периостальную.
Для остеогенных сарком характерно метастазирование в легкие (95 %), сравнительно редко в другие кости (около 10 %), мышцу сердца и т.п. обычно в финальной стадии (гематогенный путь метастазирования), что резко ухудшает прогноз. В недалеком прошлом все авторы указывали на плохие результаты лечения (хирургического, лучевого, химиотерапевтического) у большинства больных. С.А.Райнберг (1964) писал: «Прогноз при остеогенной саркоме чрезвычайно неблагоприятен. Болезнь всегда ведет к смерти..., обычные случаи «излечения» остеогенных сарком при помощи того или иного способа лечения — хирургического, лучевого или химиотерапии — относятся к диагностическим ошибкам».
Динамическое наблюдение за больными с остеогенной саркомой позволило R.Marcow и соавт. (1970), N.Jaffe и соавт. (1974), E.Cortes и соавт. (1974), C.Pratt и соавт. (1974), Z.Matejovsky и соавт. (1975), Н.Н.Трапезникову, Л.А.Ереминой и др. считать, что клинически не определяемые метастазы в легких и других органах существовали ко времени диагностирования поражения кости и что остеогенную саркому условно можно расценивать как «системное» заболевание. Следовательно, необходимо одновременное лечебное воздействие как на очаг в кости, так и на метастазы в легких, иначе больной погибнет.
Особенно трудно лечить больного с метастазами в легкие, поскольку биологические свойства метастазов изменяются. П.А.Боговский писал: «При всех этих разновидностях рецидива в гистологических препаратах можно обнаружить такую же морфологическую структуру, как и в первичном очаге. В таких случаях, исходя из положения о несопряженной прогрессии свойств опухоли, можно допустить, что возникла новая популяция опухолевых клеток, у которых прогрессировали не морфологические признаки, а, напротив, способность метастазировать или (после лечения) резистентность к лекарственным препаратам или облучению» (выделено мною. — С.З.).
А.Н.Феденко и П.А.Синюков (1989) писали, что первичная остеогенная саркома и ее метастазы в легких близки по своему строению. Все эти явления хорошо известны врачам, к сожалению, положительные результаты химиоили лучевой терапии сменяются у части больных быстрым ростом злокачественной опухоли. В отделении костной патологии взрослых ЦИТО лечилось 111 больных с остеогенной саркомой, из них 104 были оперированы. Возраст больных: 16—20 лет — 38 больных, 21—30 лет — 41, 31—40 лет 15, 41-50 лет 8, 51-60 лет 6, 61-70 лет 2, 71-80 лет 1 больной. Локализация опухоли: бедренная кость — 58 больных, большеберцовая — 21, плечевая — 12, кости таза — 6, малоберцовая кость — 3, лучевая — 4, локтевая — 1, обе кости — 1, шейный позвонок — 1, поясничный — 1, крестец — 2 больных. Большинство из них было стационировано в 1957— 1975 гг., поскольку, не имея возможности проводить современную химиотерапию, последние 20 лет мы направляли больных в специализированные онкологические отделения.
Телеангиэктатическая форма остеогенной саркомы протекает очень неблагоприятно. Мы наблюдали 12 больных с этой формой, что составляет 10,8 % всех больных с остеогенной саркомой. У нас создалось впечатление, что у больных с данной формой болевые ощущения несколько меньше.
Этот вид саркомы протекает очень злокачественно, только на ранних стадиях поражение ограничивается костью, как правило, метафизарного отдела, реакция надкостницы бывает незначительной, опухоль рано выходит за пределы кости, и, кроме внекостного ограниченного мягкотканного компонента, наблюдается пастозность окружающих мягких тканей. Вот почему так трудно, а чаще невозможно определить границы этого вида остеогенной саркомы в мягких тканях и произвести сохранную операцию.
С.А.Покровский (1954), описывая телеангиэктатический вариант остеогенной саркомы, высказывал мнение, что она относится к опухолям кровеносных сосудов кости и является кавернозной ангиосаркомой. Наличие различного размера сосудистых кист обусловливает и особую рентгенологическую картину, которая заставляет проводить дифференциальную диагностику с аневризматической кистой кости, гигантоклеточной опухолью, сосудистыми опухолями.
A.G.Huvos, G.Rosen и др. (1982) с 1921 по 1979 г. наблюдали 124 больных с телеангиэктатической формой остеогенной саркомы, которые составили 11 % всех больных с остеогенной саркомой. Возраст больных колебался от 3 до 67 лет; мужчин было 74—60 %, женщин — 50—40 %. Как и при других формах остеогенных сарком, она наиболее часто встречалась в возрасте 11—16 лет. У 36 пациентов был патологический перелом, что объясняется выраженным лизисом кости с возникновением кистозных образований, стенки которых состояли из опухолевых клеток. С 1975 г., когда начали проводить комбинированные методы лечения (преди послеоперационная химиотерапия — высокие дозы метотрексата, адриомицин или блеомицин, циклофосфан и дактиномицин), результаты лечения стали лучше.
Лечение. Многие годы онкологи доказывали, что оперативное вмешательство в объеме резекции кости при остеогенной саркоме недостаточно из-за инфильтративного роста в мягкие ткани и распространения опухоли по костномозговому каналу, поэтому необходима ампутация. М.В.Волков в 1985 г. писал: «Ампутация пока является единственным методом лечения остеогенной саркомы, который может привести к выздоровлению*.
Однако успехи ортопедов, совершенствовавших сохранные операции и применявших для замещения дефектов сначала массивные консервированные костные аллотрансплантаты, а затем специальные эндопротезы, выполнявших сохранные операции, не требующие эндопротезирования, ранняя диагностика остеогенных сарком показали, что местные рецидивы при выборе правильной методики сохранной операции сравнительно редки. По сообщению Л.А.Ереминой (1984), проведение ампутаций на протяжении пораженного диафиза показало редкость возникновения рецидивов, т.е. опровергло старое представление, согласно которому у всех больных остеогенная саркома распространяется по костномозговому каналу на большом протяжении.
В настоящее время общепринято мнение, что оперативный метод не дает надежды на излечение большинства больных как с остеогенной саркомой, так и с рядом других злокачественных опухолей. Однако нельзя относиться пренебрежительно к оперативным вмешательствам при остеогенной саркоме. Если перечитать работы, посвященные этой опухоли за последние 30 лет, то можно сделать следующие выводы:
• если сообщают о том, что кто-либо из больных живет после операции более 5 лет, это значит — был ошибочно поставлен диагноз;
• процент выживания больных в течение 5 лет колеблется от 0—4 до 17 %;
• в 60—70-е годы полностью отрицались возможность и целесообразность производства сохранных операций, но затем эти же авторы стали сторонниками сохранных операций как самостоятельного лечения, так и в комплексе с химиои лучевой терапией;
• нельзя игнорировать следующее: прогноз лучше, если опухоль имеет небольшие размеры (важность ранней диагностики); процент выживаемости выше при поражении большеберцовой кости, и ниже при поражении бедренной кости, костей таза, костей верхней конечности.
Усовершенствование методик сохранных операций и качество их выполнения продолжают играть определенную роль. Г.М.Ведзижев (1982), активно разрабатывавший и применивший сохранные операции у 29 больных с остеогенной саркомой, сообщает, что 3-летний срок прожили 15 больных (51,7 %), а 5-летний — 11 (42,3 %).
Определенных успехов удалось достичь в лечении больных с остеогенными саркомами в результате открытия препаратов высокой противоопухолевой активности: адриамицина — АД [Marcov A.D. et al., 1974], препаратов платины, которые были испытаны B.Rosenberg и соавт. (1969), и работ N.Jaffe и соавт. (1973), показавших, что применение высоких доз метотрексата с лейковорином позволяет добиться исчезновения метастазов остеогенной саркомы в легкие.
Улучшения результатов лечения удалось добиться W.W.Sutow и соавт. (1978), G.Bacci (1979), Н.Н.Трапезникову и др. (1983); еще больших успехов достигли авторы, начавшие комбинировать химиотерапию с последующими сохранными операциями [Jaffe N. et al., 1978; Marcow R.C. et al., 1980; Трапезников Н.Н. и др., 1983].
Е.Н.Федорова (1984) отметила следующие морфологические критерии патоморфоза опухоли: гибель опухолевых клеток и повреждение сосудов опухоли (альтернативные процессы), а также репаративные процессы стромы новообразования и сохранившихся элементов кости. На основании этих исследований можно судить, по ее мнению, о влиянии химиотерапевтических веществ и лучевом воздействии на опухоль.
Более того, как показал опыт зарубежных и отечественных онкологов [Трапезникова Н.Н., Еремина Л.А. и др., 1983], проведение в предоперационный период внутриартериальной инфузии адриамицина, вызывающего цитостатическое влияние на опухоль, создает благоприятные условия для проведения сохранной операции с последующей адъювантной химиотерапией.
Обнадеживающие результаты при лечении больных с остеогенной саркомой путем широкой резекции и полихимиотерапии получили также американские хирурги [Jaffe N., Frei F., 1971; Miller T.R., 1977; Marcove R.C. et al., 1977; Marcowe R.S., 1977]. За применение широких резекций при различных злокачественных опухолях костей высказывались австрийские ортопеды [Salzer M. et al., 1978].
Широкие резекции при остеогенных саркомах применяют японские хирурги (T.Ishida, A.Tateischi, S.Higaki, T.Nakada и др.). Предварительно они проводили перфузию с адриамицином в течение 30 мин, а через 2 нед — ампутацию конечности, при этом было обнаружено, что 90 % опухолевых клеток у большинства из 100 больных некротизировались. Выживание в течение 3 и 5 лет составило соответственно 37 и 34,3 %. Из 29 больных, которым систематически проводили лечение адриамицином, 1 год жили 88,6 %, 3 года — 50,1 %. Авторы предполагали, что в дальнейшем можно будет проводить химиотерапию без последующей ампутации.
Мы считаем, что, несмотря на положительный эффект от применения адриамицина, удалять первичную опухоль необходимо, при этом предпочтительна широкая резекция. Наблюдения Г.М.Ведзижева (1980), W.W.Sutow и др. (1975), N.Jaffe и др. (1977), S.A.Rosenberg и др. (1979), как и работы последующих лет, в том числе и отечественных авторов (Н.Н.Трапезникова, Л.А.Еремина и др.), показывают, что можно часть больных вылечить и продлить жизнь другим, комбинируя оперативное удаление метастазов легких с химиотерапией. Описаны наблюдения, когда излечения добивались после 3 операций — резекций легких, произведенных в течение 2—4 лет.
С 1966 г. мы начали применять сохранные операции у больных с остеогенными (и другими) саркомами. Нами были предложены эндопротезы для замещения верхнего отдела плечевой кости, всей плечевой кости, предложены модификации протеза Сиваша—Соколова для тазобедренного сустава (1969 г.), комплекс для замещения всей бедренной кости с тазобедренным и коленным суставом, который изготавливался за 4 рабочих часа и мог быть использован на следующий день для замещения верхнего конца большеберцовой кости и еще нескольких более мелких суставов (см. Аллопластика, Эндопротезирование).
Поскольку у нас в клинике было разработано эндопротезирование, мы с начала 70-х годов стали работать совместно со специалистами Онкологического научного центра им. Н.Н.Блохина — акад. Н.Н.Трапезниковым, проф. Л.А.Ереминой, акад. Ю.Н.Соловьевым, акад. Л.А.Дурновым, чл.-кор. Н.Е.Кушлинским, докт.мед.наук П.А.Симаковым, проф. В.Н.Бурдыгиным и М.Д.Алиевым.
Наша клиника помогала внедрять методы сохранных операций. Специалисты Онкологического научного центра им. Н.Н.Блохина под руководством Н.Н.Трапезникова изучали биохимические изменения в организме больных с остеогенной саркомой, проводили неоадъювантную химиотерапию, морфологические изменения в опухоли, адъювантную терапию. С 1979 г. Н.Н.Трапезниковым, Ю.Н.Соловьевым, Н.Е.Кушлинским, Л.А.Дурновым, Н.А.Синюковым, М.Д.Алиевым и др. исследовалось значение биохимических и эндокринологических показателей у 268 больных во втором десятилетии с остеогенной саркомой и другими злокачественными опухолями. Было выявлено, что для остеогенной саркомы характерна полная утрата полисиалоганглиозидов, для хондросаркомы — самые высокие уровни дисиалоганглиозидов, для опухоли Юинга — преобладание GDI (дублетный), для злокачественной фиброзной гистиоцитомы — специфический GMY (выявленный только в саркоме кости) и для гигантоклеточной опухоли — одинаковые количества СМз и О0з (синглетный) ганглиозидов.
Эти данные, впервые полученные сотрудниками РАМН, дают возможность создать новое направление в диагностике и дифференциальной диагностике различных морфологических вариантов сарком костей и в первую очередь остеогенной саркомы. Морфологами подтверждено, что при хондробластическом варианте остеогенной саркомы легочные метастазы малочувствительны к химиотерапии.
Н.Е.Кушлинским и др. была показана эндокринная зависимость остеогенной саркомы: так, концентрация инсулиноподобного фактора роста I типа в плазме больных возрастала с увеличением активности роста опухоли. По данным авторов, остеогенные саркомы содержат цитоплазматические рецепторы андрогенов в 56 % и эстрогенов — в 52 % случаев, и впервые было показано, что наличие цитозольной фракции остеогенной саркомы (рецепторов андрогенов) является неблагоприятным прогностическим фактором. В исследованиях последних лет доказано, что одним из путей ухода опухолевых клеток из-под рострегулирующего контроля организма может быть продукция ими или окружающими стромальными клетками полипептидов, стимулирующих пролиферацию, — так называемых аутои паракринных факторов роста. Эпидермальный и трансформирующие факторы роста относятся к аутои паракринным регуляторам. Н.Е.Кушлинский пришел к мнению, что остеогенная саркома у человека — опухоль, гормоночувствительная к андрогенам, которые имеют связь с ее патогенезом. Очевидно, возможна и необходима разработка эндокринологических методов лечения больных с остеогенной саркомой.
Большую роль играют простагландины Е и F2a . Эти важнейшие биохимические исследования позволяют проводить дифференциальную диагностику, судить об интенсивности роста, появлении метастазов, об эффективности неоадъювантной и адъювантной (преди послеоперационной) терапии. Несомненно, что разработка эффективных режимов химиотерапии связана с созданием высокоактивных противоопухолевых препаратов и профилактическим подходом, когда выбор основного химиотерапевтического препарата для послеоперационной химиотерапии определяется его эффективностью в отношении первичной опухоли.
Глубину регрессии опухоли после проведения неоадъювантной терапии принято подразделять на 4 степени:
• I степень — после химиоили лучевой терапии отмечался незначительный эффект (или эффекта не было);
• II степень — около 50 % ткани опухоли некротизировалось;
• III степень — более 90 % опухоли некротизировалось;
• IV степень — полное отсутствие жизнеспособности опухоли.
Если профилактическая терапия позволила добиться III—IV степени воздействия на опухоль, то в послеоперационном периоде продолжается лечение этим же препаратом; если эффект лечения слабый, то химиотерапия (адъювантная) проводится другими препаратами.
С 1968 г. в ОНЦ им. Н.Н.Блохина под руководством Н.Н.Трапезникова было начато целенаправленное исследование.
Неадъювантная химиотерапия проводилась в трех основных режимах, каждому из которых соответствовали следующие показания. Предоперационная химиотерапия: первый режим — внутриартериальная инфузия цисплатина (платидиама) в дозе 150 мг/м2 в течение 3 ч. В зависимости от ответа опухоли, который контролировался клинически, рентгенологически (ангиография, компьютерная томография) и сканографически, больные получали от 2 до 6 курсов химиотерапии с интервалом 3—4 нед, после чего им выполняли операцию. Вторая схема подразумевала использование метотрексата высокими дозами (8—12 г/м2 ) под защитой лейковорина в виде 2— 3 курсов с интервалом 2—3 нед. Третий режим включал внутриартериальное введение адриамицина в дозе 30 мг/м2 в сутки в течение 3 дней. В зависимости от ответа опухоли больные получают 1—2 курса с интервалом 3—4 нед.
Хирургическое вмешательство. При отсутствии осложнений через 3—4 нед после окончания очередного курса химиотерапии выполняли хирургический этап лечения. Объем операции зависел от степени местного распространения первичной опухоли. Сохранные операции в виде широкой сегментарной резекции кости выполняли при ограниченных поражениях без вовлечения в опухолевый процесс магистральных сосудов и окружающих мягких тканей. При показаниях были вынуждены прибегать к более расширенным операциям типа ампутаций или экзартикуляций.
1. Если при применении внутриартериальной инфузии препаратов платины достигался выраженный эффект (степень повреждения опухоли составляла 90 % и более), то дополнительная химиотерапия включала: внутривенную инфузию цисплатина (платидиама) в дозе 30—40 мг/м2 в 1—3-й дни цикла или 100 мг/м2 однократно на фоне поддерживающей гипергидратации и форсированного диуреза; внутривенное введение адриамицина — 40—50 мг/м2 в первый день и циклофосфана в дозе 500—600 мг/м2 во 2-й день (схема САР). В зависимости от переносимости лечение состояло из 6 курсов с интервалом 4 нед. При незначительных проявлениях лекарственного патоморфоза назначали адъювантную химиотерапию адриамицином.
Препарат вводили внутривенно по 30 мг/м2 в течение 3 дней. Интервалы между циклами составляли 3—4 нед, всего проводили 6 курсов. Показатель 4-летней выживаемости без признаков заболевания при III—IV степени повреждения опухоли после внутриартериальной инфузии цисплатина составил 74,1 % (больные с IV степенью повреждения наблюдались в этот срок без каких-либо признаков основного заболевания). Представленный показатель в 5 раз достоверно превышал аналогичные данные в группе больных, получавших хирургическое лечение (р<0,001). При лечении больных остеогенной саркомой детей уровни 4и 5-летней выживаемости равны и составляют 52,5 % (р<0,05).
2. Если при применении в предоперационном периоде высоких доз метотрексата с лейковорином отмечался выраженный эффект, то адъювантная химиотерапия включала: внутривенную инфузию метотрексата дозами по 8 мг/м2 под защитой лейковорина в виде 3 курсов с интервалом 3 нед, чередующихся с введением адриамицина по 30 мг/м2 в течение 3 дней (3 курса с аналогичным интервалом). В альтернативной ситуации использевалась схема САР. После предоперационной химиотерапии высокими дозами метотрексата с лейковорином показатель 4-летней безметастатической выживаемости составил 33,3 %.
3. Если применение в предоперационном периоде внутриартериальной инфузии адриамицина сопровождалось значительным повреждением первичной опухоли, поддерживающую химиотерапию проводили по схеме САР.
Послеоперационную (адъювантную) химиотерапию начинали на 12— 14-й день после операции, т.е. к моменту заживления раны, и проводили с использованием 3 режимов лечения.
1. Больным первой группы назначали многокомпонентную программу с включением препаратов различного механизма действия: адриамицин, циклофосфан, винкристин, сарколизин. Лечение продолжали в течение 76 дней по следующей схеме: адриамицин по 0,75 мг/кг в 1-й, 3-й, 6-й, 18-й, 21-й и 24-й дни; по 0,5 мг/кг в 36-й, 37-й, 54-й и 55-й дни лечения; циклофосфан — по 5 мг/кг ежедневно в течение 7 дней тремя курсами; винкристин вводили по 0,025 мг/кг один раз в 7 дней на протяжение 76 дней (всего 12 раз); сарколизин — по 0,3 мг/кг на 30-й, 42-й, 60-й и 72-й дни лечения. В среднем на курс лечения больные получали 260—390 мг адриамицина, 12—20 мг винкристина, 3700—5900 мг циклофосфана и 60—80 мг сарколизина.
Основной показатель эффективности адъювантной химиотерапии — время появления метастазов. Изучение отдаленных результатов показало, что в группе больных, получавших адъювантную химиотерапию, 5 лет без метастазов прожили 30,5 % больных, тогда как только при хирургическом методе этот показатель составил 7 %. Дополнительная химиотерапия улучшает результаты более чем в 3,5 раза (р,05).
2. Во второй группе проводили адъювантную химиотерапию адриамицином. Препарат вводили внутривенно по 30 мг/м2 в течение 3 дней. Интервалы между циклами составили 3—4 нед, всего проводили 6 курсов. Изучение отдаленных результатов показало, что в течение 5 лет без метастазов прожили 53,2 % больных (р,001). У детей этот показатель несколько ниже — 36,8 % (р,05).
3. В третьей группе адъювантная химиотерапия (схема САР) включала: внутривенную инфузию цисплатина (платидиама) в дозе 30—40 мг/м2 в 1 — 3-й дни цикла на фоне поддерживающей гипергидратации и форсированного диуреза, внутривенное введение адриамицина по 40—50 мг/м2 в первый день и циклофосфана в дозе 500—600 мг/м2 во 2-й день. В зависимости от переносимости лечение состояло из 6—9 курсов с интервалом 4 нед. Больные с 5-летней выживаемостью без метастазов в этой группе составили 45,5 % (р<0,001).
Таким образом, проведенное исследование показало, что при любой из схем адъювантной (профилактической) химиотерапии показатели выживаемости без метастазов были в 3—4 раза достоверно выше, чем при чисто хирургическом вмешательстве.
Таковы блестящие достижения современного лечения в ОНЦ им. Н.Н.Блохина, проводимого группой под руководством академика Н.Н.Трапезникова.
Проведенные в ОНЦ исследования по лечению множественных метастазов остеогенной саркомы в легких по двум основным программам показали следующее.
1. В первой группе больных химиотерапию применяли по схеме САР: платидиам по 30—40 мг/м2 в 1—3-й дни, адриамицин — по 400—600 мг/м2 на 2-й день у 62 больных с множественным поражением легких. Ранее эти больные получали комбинированное лечение, включающее радикальные операции различного объема, в том числе и резекции кости с замещением дефекта аллокостью или эндопротезом; у большинства из них проводили преди послеоперационную химиотерапию с использованием адриамицина. Эффект лечения отмечен у 30,8 % больных.
2. Во второй группе больных из 34 человек также с множественными метастазами использовали метотрексат в дозах от 300 мг/м2 до 8 г/м2 с лейковорином (метастазы у больных возникли после радикального удаления первичной опухоли вскоре или на фоне адъювантной химиотерапии с использованием антрациклинов или производных платины). Эффект лечения отмечен у 20,6 % больных.
Применяются и другие схемы полихимиотерапии. Изучение представленных программ показало, что повышение эффективности терапии метастазов остеогенной саркомы в легких возможно путем комбинации лекарственного лечения и хирургического вмешательства.
Следует отметить, что под влиянием современной химиотерапии несколько изменились биологические особенности данной опухоли. Если раньше, по данным Онкологического научного центра им. Н.Н.Блохина, преобладали множественные метастазы, а солитарные и единичные опухоли составляли 9,9 %, то теперь на фоне адъювантной химиотерапии указанный характер поражения отмечен в 64 % наблюдений. В настоящее время наличие солитарного или единичных метастазов опухоли в легких представляет ту клиническую ситуацию, когда существует возможность оказать больному реальную помощь.
Программа терапии следующая: 1) предоперационная химиотерапия; 2) оценка эффективности лечения; 3) хирургическое лечение; 4) гистологическая оценка лекарственного патоморфоза; 5) послеоперационная поддерживающая (адъювантная) химиотерапия.
Предоперационная химиотерапия. Лечение наиболее часто начинали с химиотерапии по схеме САР: платидиам по 30—40 мг/м2 в 1—3-й дни; адриамицин по 40—50 мг/м2 на 2-й день. Реже применяли высокие дозы метотрексата — от 2,5 до 3,5 г/м2 — с лейковорином. В обоих случаях проводили 2 курса химиотерапии. После операции — адъювантная химиотерапия. Следует отметить, что полихимиотерапия может проводиться только специалистами высокого класса.
К сожалению, ортопедам, занимающимся костной патологией и разрабатывающим сохранные операции, выпадает тяжелая миссия оперировать тех больных с остеогенной саркомой, которым онкологи не нашли возможным в комплексном лечении предложить резекцию и настаивали на ампутации, от которой больные отказывались. Однако существует определенная группа больных с остеогенной саркомой, у которых нет первичного поражения легких и метастазы развиваются не в первые годы после операции. Именно эта группа больных должна представить предмет особого всестороннего изучения специалистов.
Больная Б-ва, 16 лет, обратилась в больницу Ярославля по поводу болей и припухлости в верхней трети левой голени.
12.VII.88 г. произведена открытая биопсия. Направлена в ВОНЦ АМН СССР, где был поставлен диагноз остеогенной саркомы и рекомендована ампутация бедра. Больная отказалась от операции и обратилась в отделение костной патологии взрослых ЦИТО, где была произведена резекция единым блоком верхнего конца большеберцовой кости с верхним концом малоберцовой кости, окружающими тканями, капсулой коленного сустава и менисками.
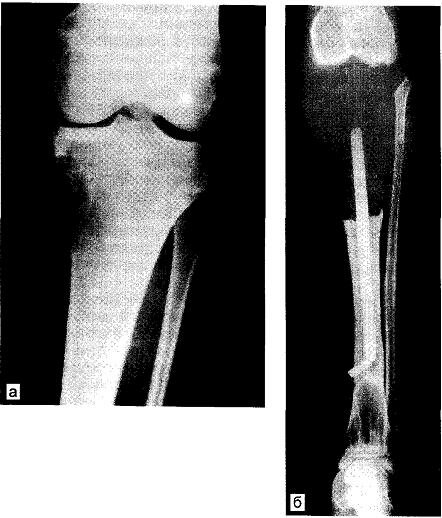
Рис. 26.1. Телеангиэктатическая саркома верхнего конца большеберцовой кости у больной М., 17 лет. а — опухолевая деструкция на внутренней поверхности большеберцовой кости; б — для снижения внутрикостного давления через кортикальный слой к нижнему концу ножки эндопротеза введена канюля. Боли при ходьбе исчезли. Через 14 лет больная здорова.
Дефект замещен эндопротезом из метилметакрилата на титановой ножке, введенным в костномозговую полость большеберцовой кости (эндопротез С.Т.Зацепина). При нагрузке на ногу появлялась незначительная боль, обусловленная поршневыми движениями и повышением давления в костномозговом канале (рис. 26.1). Чтобы снизить давление, мы просверлили кортикальный слой кости на уровне конца титановой ножки и ввинтили трубочку, которая обеспечила сообщение жидкости костномозгового канала и мышечного пространства. Боли исчезли.
На распиле во фронтальной плоскости: часть эпифиза, большая часть метафиза и часть костномозгового канала диафиза занимают очаг неправильной формы, размерами 8,5x5x4 и 4x4x3 см. Над метафизом с внутренней стороны кости на площади 5x4 см кортикальная пластинка кости разрушена. Основной объем очага представлен множественными кистами диаметром от 0,5 до 2,5 см, заполненными жидкой кровью. Перегородки между кистами тончайшие, просвечивающие. Самый наружный прилегающий к окружающей костной ткани слой очага (он имеется только местами) представлен мягкой розовой тканью, толщина которой колеблется от 0,2 до 1,5 см. Наибольшей ширины — 1,5 см — эта ткань достигает в зоне, где костная кортикальная пластинка разрушена.
Заключение: опухоль имеет строение остеогенной саркомы — телеангиэктатический вариант.
Консультирована в ВОНЦ: нуждается в наблюдении; химиотерапия будет проведена в случае появления метастазов. Больная здорова в течение 13 лет. Окончила школу и институт, работает, ходит без палочки, танцует.
Это один из редких случаев, когда при телеангиэктатическом варианте остеогенной саркомы получен благоприятный исход оперативного лечения.
Второй больной — с полиоссальной формой фиброзной дисплазии: телеангиэктотическая саркома развилась в правой бедренной кости, которая несколько раз подвергалась операции и вытяжению с целью удлинения. Произведена межподвздошно-брюшная ампутация. Больной жив 19 лет.
С.Т.Зацепин
Костная патология взрослых
По данным ВОНЦ АМН РФ, с 1952 по 1985 г. лечилось 350 больных с остеогенной саркомой, что составило 38,3 % больных с саркомой костей.
В 1922 г. J.Ewing предложил называть саркомы, происходящие из костных клеток, «остеогенными саркомами», следовательно, в эту группу опухолей входили и паростальная саркома, и хондросаркома. Последующими исследователями был внесен целый ряд уточнений [Виноградова Т.П., 1973; Kolodny А., 1927; Phemister D.W., 1930; Geschickter C.F., Copeland M.M., 1951], в результате чего пришли к единому мнению, выраженному в международной гистологической классификации костных опухолей 1974 г.: остеосаркома, остеогенная саркома — это злокачественная опухоль, характеризующаяся непосредственным образованием кости или остеоида опухолевыми клетками. Обнаружение в клетках опухоли щелочной фосфатазы с помощью гистохимического исследования может помочь проведению дифференциальной диагностики.
Т.П.Виноградова (1973) особенно подчеркивала, что хотя и принят термин «остеогенная саркома» (происходящая из костеобразующей ткани), ее правильнее было бы называть «остеогенетической саркомой», т.е. образующей костную ткань; следовательно, правомочен также термин «остеопластическая» независимо от того, имеется ли остеопоротическая или остеосклеротическая форма. Т.П.Виноградова принципиально возражала и против употребления широко распространенного названия «остеосаркома», считая его собирательным, неточным.
Остеогенная саркома, как правило, возникает в одной кости, но описаны и множественные поражения костей, а также возникновение остеогенной саркомы у 2 сестер и брата практически в одно и то же время [Roberts C.W., Roberts С.P., 1935]. Предположение, что остеогенная саркома возникает из мультипотентных мезенхимальных клеток, подтверждается, по нашему мнению, тем фактом, что описаны больные с внескелетными остеогенными саркомами, развивающимися в мыщцах, матке, почках, щитовидной железе, молочной железе и других тканях, причем опухоли не связаны с рядом расположенными костями. О внескелетных остеогенных саркомах упоминает и Т.П.Виноградова (1973). R.Lorentzon и соавт. (1979) сообщили о 4 больных, из которых в течение 2 лет умерли трое и один жив 14 лет. По данным этих авторов, в 1978 г. в англоязычной литературе описано 107 больных с внекостной остеогенной саркомой, средний возраст которых составил 51 год. Рецидивы опухоли возникают как правило, поэтому необходимы широкие резекции с соблюдением принципа зональности и футлярности, а также современная полихимиотерапия.
R.I.Ferguson, E.I.Junis (1978) на основании электронно-микроскопического изучения остеогенных сарком идентифицирует следующие типы клеток: примитивные недифференцированные мезенхимальные клетки и клетки с морфологическими признаками остеобластов, хондробластов и фибробластов в сочетании с многоядерными клетками, часть из которых подобны остеокластам, тогда как в других клетках имеются анапластические и дегенеративные изменения. Авторы полагают, что эти примитивные мезенхимальные клетки являются плюрипотенциальными клетками, способными дифференцироваться в различные клетки. К подобным выводам пришли Л.В.Литвинова (1976), D.Katenkamp и др. (1978), E.Grundmako и соавт. (1981). A.Roessner и соавт. к указанным видам клеток прибавили клетки ангиогенной природы и миофибробластической дифференцировки.
В.Ф.Кондаленко и др. (1987) при электронно-микроскопическом исследовании остеогенных и паростальных сарком обнаружили различия во внеклеточном матриксе, в частности протеогликанов. Они считают, что отличие в структуре протеогликанов обусловливает направление и уровень дифференцировки клеток опухоли, что и определяет степень злокачественности опухоли. Так, они обнаружили резкое отличие в структуре протеогликанов в матриксе паростальной и остеогенной сарком, которые клинически резко различаются в своей злокачественности.
Электронно-микроскопические данные свидетельствуют о том, что остеогенная саркома, как и другие виды опухолей, может происходить из примитивных недифференцированных мезенхимальных клеток, прямо связанных с рядом биохимических процессов; некоторые из них приведены ниже.
В опухолевых клетках тканеспецифические белки отсутствуют или их очень мало, как и ферментов, характерных для нормальных тканей. На этом основании считают, что предшественниками опухолевых клеток являются низкодифференцированные клетки [Potter V.R., 1969, и др.] или возникновение злокачественных опухолей (клеток) связано с процессом недифференцировки, или ретродифференцировки, — процессом, который предшествует появлению опухолевых клеток [Оленев Ю.М., 1977; Uriel J., 1979; Curtin N.J., Snell К., 1983].
Прямое участие в развитии опухолевых клеток принимают ферменты, которые подразделяют на две группы: 1) ферменты, обеспечивающие процесс пролиферации, и 2) ферменты, включенные в системы передачи в клетку регуляторных сигналов извне, т.е. осуществляющие регуляцию пролиферации [Ходостова И.А., 1988].
Длительное время как о чем-то таинственном говорилось об автономности опухолевого роста. Эта особенность присуща опухолевым клеткам и определяет их свойства, но необъяснима. В последние годы было показано, что некоторые протеинкиназы находятся в связи с рецепторами факторов роста, а системы циклических нуклеотидов и ферментов их метаболизма приобретают важное значение в делении клеток нормальных тканей. Было обнаружено также, и это особенно важно, что в опухолевых тканях имеются существенные отклонения характеристик ряда ферментов, участвующих в пролиферации клеток. Это и определяет их автономный рост. Так объясняется с биохимических позиций автономность роста опухоли.
И наконец, клетка обладает, с одной стороны, возможностью активировать положительные, необходимые в данное время процессы, а с другой — давать начало процессам, отрицательно отражающимся на функции всего организма или какого-либо органа, ткани. Процессы регуляции активности генов деятельности ДНК (торможение ее функции) происходят в результате сложных процессов, одним из которых является метилирование ДНК ферментами ДНК — метилазами. Химические канцерогены нарушают, изменяют, снижают процесс метилирования ДНК, в результате чего ряд генов (онкогены), кодирующих синтез белков и определяющих появление опухолевых клеток, начинают функционировать и вызывают дифференцировку примитивных недифференцированных мезенхимальных клеток в опухолевую ткань. Нужно помнить, что гены состоят из четырех нуклеотидных оснований: аденина (А), темина (Т), цитозина (Ц), гуанина (Г). Разные комбинации А, Т, Ц и Г кодируют различные белки.
Как известно, в 1960 г. была открыта согласуемая хромосомная аберрация в опухолевых клетках при хронической миеломной лейкемии, и с тех пор продолжаются исследования хромосом с точки зрения ракового цитогенеза. N.Mandahl и A.Rydholm (1989) опубликовали данные, полученные ими и другими исследователями, изучавшими изменения в хромосомах у больных со следующими опухолями костей: саркомой Юинга, остеогенной саркомой, хондромами, хондросаркомами, злокачественной фиброзной гистиоцитомой, синовиальной саркомой, липомой, липосаркомой и некоторыми другими.
При остеогенной саркоме только в незначительном числе клеток хромосомы оставались неизменными, а в большинстве клеток были обнаружены сложные изменения в наборах хромосом, наблюдались клетки как гиподиплоидные, так и приближающиеся почти до гексадиплоидного уровня, в большинстве опухолей обнаруживались участки с триплоидными и тетраплоидными клетками. Можно надеяться, что изучение хромосом злокачественных опухолей позволит лучше понять процессы, происходящие в клетках. Н.А.Краевский и Ю.Н.Соловьев (1971) описали важные наблюдения, имеющие значение в патои морфогенезе остеогенной саркомы. В теоретическом аспекте они исходили из известного положения о предшествующих опухолевому росту явлениях диспластического и дистрофического характера, согласно которому глубокие метаболические нарушения, приводящие к изменениям в клетках и тканях, влияют на их дифференцировку и являются обязательным условием возникновения опухолей. Изменения энхондрального остеогенеза непосредственно связаны с процессами кровоснабжения и особенностями метаболизма хрящевой ткани зоны роста длинных трубчатых костей, что приводит к нарушению процессов превращения хрящевой ткани в костную, а в период интенсивного роста кости может обусловить появление диспластической хрящевой ткани.
Изучение костей, пораженных остеогенной саркомой, у ряда больных в возрасте 12—18 лет позволило Н.А.Краевскому и Ю.Н.Соловьеву выявить отчетливые признаки задержки резорбции хряща и смещение участков метафизарной спонгиозы по оси в диафизарном направлении с отрывом их от эпифизарной хрящевой пластинки. Фактически подобные изменения представляют собой полный аналог зоны, или «пояска» (в известной мере эктопированного), костеобразования, которое наблюдается и при экспериментальном воспроизведении опухолей скелета. Единственным реальным объяснением этого явления может быть только трактовка его с позиции нарушения синхронности процессов костеобразования (энхондрального остеогенеза) и процесса роста кости.
Как показали исследования Ederer (1965) и J.E.Fraumani (1967), существует достоверный параллелизм между увеличением и ускорением роста в возрасте 12—17 лет и частотой возникновения остеогенной саркомы. По данным Ю.Н.Соловьева (1959), редукция сосудистого русла костей вблизи зон роста у экспериментальных животных приводит к угнетению энхондрального остеогенеза в зонах роста и персистенции хряща эпифизарных пластинок.
По сообщению Н.А.Краевского и Ю.Н.Соловьева, у 98,5 % больных остеогенная саркома возникла в длинных трубчатых костях, а у 80 % развилась в дистальном конце бедренной кости и проксимальных концах большеберцовой и малоберцовой костей, т.е. ростковых зонах, обладающих наибольшей скоростью роста. Известно, что остеогенная саркома наблюдается у пород собак высокого роста и не встречается у низкорослых собак, что нужно прямо связать со скоростью роста костей за счет эпифизарных зон.
В настоящее время морфологические данные являются основой, на которой строятся наши представления о патогенезе и развитии опухолей. Процессы, определяющие опухолевые клетки и предшествующие возникновению опухоли как таковой, известны, но не настолько детально изучены, чтобы в своей практической деятельности врачи различных специальностей могли бы улавливать момент возникновения опухоли, точную ее локализацию и направленность изменений биохимических процессов в межклеточной субстанции, которые определяют возникновение новой опухолевой популяции клеток, развивающихся из мезенхимальных клеток — клеток-предшественников, стволовых клеток. Следует считать, что опухолевые клетки возникают под влиянием воздействия многочисленных физических (малоизученных), биохимических нарушений, а также атомных, молекулярных метаболических отклонений, которые приводят к изменениям генов и нарушениям в ДНК, обусловливающим начало опухолевого роста.
Н.Н.Трапезников и соавт. (1983) указывали, что во втором десятилетии жизни возникают 80 % остеогенных сарком, при этом у мальчиков 11 — 15 лет они встречаются реже (37,5 %), чем у девочек того же возраста (62,5 %). Противоположное соотношение наблюдается в следующее пятилетие: среди мужчин 16—20 лет опухоль развивается у 62,5 %, а среди женщин того же возраста — у 37,5 %. Приведенные статистические данные с несомненностью говорят о значении эндокринных влияний, скорости роста длинных трубчатых костей в длину за счет зон роста костей, где возникает 97 % опухолей, а в 80 % опухолей развиваются в зонах с наиболее интенсивным ростом: это нижний метафиз бедренной кости, верхний метафиз плечевой кости, затем следуют кости таза, верхняя и нижняя челюсти, позвоночник, ребра, лопатка, кости предплечья, стопы, кисти, при этом определенную роль играет размер площади зоны роста. Отмечено, что у подростков, юношей, девушек высокого роста вероятность возникновения опухоли больше.
Некоторые авторы считают, что травма может способствовать началу развития опухоли, если имеется «готовность» тканей к опухолевому процессу, а по мнению других — если имеются бластоматозные клетки. Согласно нашим наблюдениям травма способствовала лишь выявлению уже существовавшего опухолевого процесса.
Клиническая картина остеогенной саркомы характерна и соответствует проявлениям быстро растущих злокачественных опухолей. Особенно характерна боль, появляющаяся раньше видимой опухоли; сильная боль отмечается днем и ночью, рано развиваются атрофия мышц, сгибательная контрактура в суставе (наиболее часто в коленном). Повышение местной температуры, истощение, усиленная сеть подкожных вен, метастазы в легких появляются позднее. У части больных все клинические проявления протекают бурно, а у другой части — они менее выражены и развитие опухоли происходит медленнее.
Рентгенологическая картина зависит от многих причин: центрального или периферического расположения очага опухоли, превалирования тех или иных гистологических структур, процессов, сопровождающих рост опухоли. Принято выделять остеолитический и остеосклеротический варианты, а также хондробластический и телеангиэктатический типы остеогенной саркомы. Согласно данным Н.Н.Трапезникова, Л.А.Ереминой, Ю.Н.Соловьева и др. менее агрессивное течение наблюдается при остеосклеротическом и хондробластическом типах и более агрессивное — при остеолитическом и телеангиэктатическом типах, однако это бывает не всегда, так как при остеосклеротическом типе возможно и очень злокачественное течение.
При остеолитическом типе наблюдаются преимущественно процессы разрушения, лизиса кости; при телеангиэктатическом типе наряду с разрушениями происходит формирование плотных костных опухолевых масс, имеющих на рентгенограммах характерный склеротический вид. Широко известны такие рентгенологические симптомы, как спикулы и периостальный козырек Кодмана. У некоторых больных эти симптомы нерезко выражены, и тогда диагностика представляет значительные трудности; ошибки в диагнозе ведут к неправильному лечению.
Сцинтиграфия является ценным диагностическим методом, позволяющим рано выявить первичный очаг и определить состояние всего скелета. Е.К.Колесникова и А.В.Забродина (1988) показали, что возможности компьютерной томографии в диагностике остеогенной саркомы очень велики, поскольку хорошо видны такие изменения кортикального слоя кости, как разрыхление, расслоение, прерывистость, а также изменения надкостницы, ее отслоение, появление спикул, хорошо виден внекостный компонент опухоли.
Гистологическое строение остеогенной саркомы весьма разнообразно. Это относится как к разным больным, так и к различным участкам опухоли. Клетки то напоминают остеобласты, то имеют округленную, веретенообразную форму. В опухолевой ткани характерно наличие большего или меньшего количества атипичных костных обызвествленных или необызвествленных остеоидных структур (Т.П.Виноградова).
Тщательно проведенные на большом материале исследования И.В.Забродиной (1995) показали, что в 9,8 % случаев метастазы остеогенной саркомы выявляются в костях при еще интактных легких. Это еще раз подтверждает нашу гипотезу, что метастазирование возникает более легко и, следовательно, чаще в тканях, которые по строению близки к ткани опухоли, когда сходно строение «географических мембран» клеток опухолей и клеток тканей.
И.В.Забродиной (1995) детально разработаны критерии ранней диагностики опухоли в зависимости от ее локализации: губчатая кость, кортикальная кость, периост. Она также описала две редкие локализации остеогенной саркомы — интракортикальную и периостальную.
Для остеогенных сарком характерно метастазирование в легкие (95 %), сравнительно редко в другие кости (около 10 %), мышцу сердца и т.п. обычно в финальной стадии (гематогенный путь метастазирования), что резко ухудшает прогноз. В недалеком прошлом все авторы указывали на плохие результаты лечения (хирургического, лучевого, химиотерапевтического) у большинства больных. С.А.Райнберг (1964) писал: «Прогноз при остеогенной саркоме чрезвычайно неблагоприятен. Болезнь всегда ведет к смерти..., обычные случаи «излечения» остеогенных сарком при помощи того или иного способа лечения — хирургического, лучевого или химиотерапии — относятся к диагностическим ошибкам».
Динамическое наблюдение за больными с остеогенной саркомой позволило R.Marcow и соавт. (1970), N.Jaffe и соавт. (1974), E.Cortes и соавт. (1974), C.Pratt и соавт. (1974), Z.Matejovsky и соавт. (1975), Н.Н.Трапезникову, Л.А.Ереминой и др. считать, что клинически не определяемые метастазы в легких и других органах существовали ко времени диагностирования поражения кости и что остеогенную саркому условно можно расценивать как «системное» заболевание. Следовательно, необходимо одновременное лечебное воздействие как на очаг в кости, так и на метастазы в легких, иначе больной погибнет.
Особенно трудно лечить больного с метастазами в легкие, поскольку биологические свойства метастазов изменяются. П.А.Боговский писал: «При всех этих разновидностях рецидива в гистологических препаратах можно обнаружить такую же морфологическую структуру, как и в первичном очаге. В таких случаях, исходя из положения о несопряженной прогрессии свойств опухоли, можно допустить, что возникла новая популяция опухолевых клеток, у которых прогрессировали не морфологические признаки, а, напротив, способность метастазировать или (после лечения) резистентность к лекарственным препаратам или облучению» (выделено мною. — С.З.).
А.Н.Феденко и П.А.Синюков (1989) писали, что первичная остеогенная саркома и ее метастазы в легких близки по своему строению. Все эти явления хорошо известны врачам, к сожалению, положительные результаты химиоили лучевой терапии сменяются у части больных быстрым ростом злокачественной опухоли. В отделении костной патологии взрослых ЦИТО лечилось 111 больных с остеогенной саркомой, из них 104 были оперированы. Возраст больных: 16—20 лет — 38 больных, 21—30 лет — 41, 31—40 лет 15, 41-50 лет 8, 51-60 лет 6, 61-70 лет 2, 71-80 лет 1 больной. Локализация опухоли: бедренная кость — 58 больных, большеберцовая — 21, плечевая — 12, кости таза — 6, малоберцовая кость — 3, лучевая — 4, локтевая — 1, обе кости — 1, шейный позвонок — 1, поясничный — 1, крестец — 2 больных. Большинство из них было стационировано в 1957— 1975 гг., поскольку, не имея возможности проводить современную химиотерапию, последние 20 лет мы направляли больных в специализированные онкологические отделения.
Телеангиэктатическая форма остеогенной саркомы протекает очень неблагоприятно. Мы наблюдали 12 больных с этой формой, что составляет 10,8 % всех больных с остеогенной саркомой. У нас создалось впечатление, что у больных с данной формой болевые ощущения несколько меньше.
Этот вид саркомы протекает очень злокачественно, только на ранних стадиях поражение ограничивается костью, как правило, метафизарного отдела, реакция надкостницы бывает незначительной, опухоль рано выходит за пределы кости, и, кроме внекостного ограниченного мягкотканного компонента, наблюдается пастозность окружающих мягких тканей. Вот почему так трудно, а чаще невозможно определить границы этого вида остеогенной саркомы в мягких тканях и произвести сохранную операцию.
С.А.Покровский (1954), описывая телеангиэктатический вариант остеогенной саркомы, высказывал мнение, что она относится к опухолям кровеносных сосудов кости и является кавернозной ангиосаркомой. Наличие различного размера сосудистых кист обусловливает и особую рентгенологическую картину, которая заставляет проводить дифференциальную диагностику с аневризматической кистой кости, гигантоклеточной опухолью, сосудистыми опухолями.
A.G.Huvos, G.Rosen и др. (1982) с 1921 по 1979 г. наблюдали 124 больных с телеангиэктатической формой остеогенной саркомы, которые составили 11 % всех больных с остеогенной саркомой. Возраст больных колебался от 3 до 67 лет; мужчин было 74—60 %, женщин — 50—40 %. Как и при других формах остеогенных сарком, она наиболее часто встречалась в возрасте 11—16 лет. У 36 пациентов был патологический перелом, что объясняется выраженным лизисом кости с возникновением кистозных образований, стенки которых состояли из опухолевых клеток. С 1975 г., когда начали проводить комбинированные методы лечения (преди послеоперационная химиотерапия — высокие дозы метотрексата, адриомицин или блеомицин, циклофосфан и дактиномицин), результаты лечения стали лучше.
Лечение. Многие годы онкологи доказывали, что оперативное вмешательство в объеме резекции кости при остеогенной саркоме недостаточно из-за инфильтративного роста в мягкие ткани и распространения опухоли по костномозговому каналу, поэтому необходима ампутация. М.В.Волков в 1985 г. писал: «Ампутация пока является единственным методом лечения остеогенной саркомы, который может привести к выздоровлению*.
Однако успехи ортопедов, совершенствовавших сохранные операции и применявших для замещения дефектов сначала массивные консервированные костные аллотрансплантаты, а затем специальные эндопротезы, выполнявших сохранные операции, не требующие эндопротезирования, ранняя диагностика остеогенных сарком показали, что местные рецидивы при выборе правильной методики сохранной операции сравнительно редки. По сообщению Л.А.Ереминой (1984), проведение ампутаций на протяжении пораженного диафиза показало редкость возникновения рецидивов, т.е. опровергло старое представление, согласно которому у всех больных остеогенная саркома распространяется по костномозговому каналу на большом протяжении.
В настоящее время общепринято мнение, что оперативный метод не дает надежды на излечение большинства больных как с остеогенной саркомой, так и с рядом других злокачественных опухолей. Однако нельзя относиться пренебрежительно к оперативным вмешательствам при остеогенной саркоме. Если перечитать работы, посвященные этой опухоли за последние 30 лет, то можно сделать следующие выводы:
• если сообщают о том, что кто-либо из больных живет после операции более 5 лет, это значит — был ошибочно поставлен диагноз;
• процент выживания больных в течение 5 лет колеблется от 0—4 до 17 %;
• в 60—70-е годы полностью отрицались возможность и целесообразность производства сохранных операций, но затем эти же авторы стали сторонниками сохранных операций как самостоятельного лечения, так и в комплексе с химиои лучевой терапией;
• нельзя игнорировать следующее: прогноз лучше, если опухоль имеет небольшие размеры (важность ранней диагностики); процент выживаемости выше при поражении большеберцовой кости, и ниже при поражении бедренной кости, костей таза, костей верхней конечности.
Усовершенствование методик сохранных операций и качество их выполнения продолжают играть определенную роль. Г.М.Ведзижев (1982), активно разрабатывавший и применивший сохранные операции у 29 больных с остеогенной саркомой, сообщает, что 3-летний срок прожили 15 больных (51,7 %), а 5-летний — 11 (42,3 %).
Определенных успехов удалось достичь в лечении больных с остеогенными саркомами в результате открытия препаратов высокой противоопухолевой активности: адриамицина — АД [Marcov A.D. et al., 1974], препаратов платины, которые были испытаны B.Rosenberg и соавт. (1969), и работ N.Jaffe и соавт. (1973), показавших, что применение высоких доз метотрексата с лейковорином позволяет добиться исчезновения метастазов остеогенной саркомы в легкие.
Улучшения результатов лечения удалось добиться W.W.Sutow и соавт. (1978), G.Bacci (1979), Н.Н.Трапезникову и др. (1983); еще больших успехов достигли авторы, начавшие комбинировать химиотерапию с последующими сохранными операциями [Jaffe N. et al., 1978; Marcow R.C. et al., 1980; Трапезников Н.Н. и др., 1983].
Е.Н.Федорова (1984) отметила следующие морфологические критерии патоморфоза опухоли: гибель опухолевых клеток и повреждение сосудов опухоли (альтернативные процессы), а также репаративные процессы стромы новообразования и сохранившихся элементов кости. На основании этих исследований можно судить, по ее мнению, о влиянии химиотерапевтических веществ и лучевом воздействии на опухоль.
Более того, как показал опыт зарубежных и отечественных онкологов [Трапезникова Н.Н., Еремина Л.А. и др., 1983], проведение в предоперационный период внутриартериальной инфузии адриамицина, вызывающего цитостатическое влияние на опухоль, создает благоприятные условия для проведения сохранной операции с последующей адъювантной химиотерапией.
Обнадеживающие результаты при лечении больных с остеогенной саркомой путем широкой резекции и полихимиотерапии получили также американские хирурги [Jaffe N., Frei F., 1971; Miller T.R., 1977; Marcove R.C. et al., 1977; Marcowe R.S., 1977]. За применение широких резекций при различных злокачественных опухолях костей высказывались австрийские ортопеды [Salzer M. et al., 1978].
Широкие резекции при остеогенных саркомах применяют японские хирурги (T.Ishida, A.Tateischi, S.Higaki, T.Nakada и др.). Предварительно они проводили перфузию с адриамицином в течение 30 мин, а через 2 нед — ампутацию конечности, при этом было обнаружено, что 90 % опухолевых клеток у большинства из 100 больных некротизировались. Выживание в течение 3 и 5 лет составило соответственно 37 и 34,3 %. Из 29 больных, которым систематически проводили лечение адриамицином, 1 год жили 88,6 %, 3 года — 50,1 %. Авторы предполагали, что в дальнейшем можно будет проводить химиотерапию без последующей ампутации.
Мы считаем, что, несмотря на положительный эффект от применения адриамицина, удалять первичную опухоль необходимо, при этом предпочтительна широкая резекция. Наблюдения Г.М.Ведзижева (1980), W.W.Sutow и др. (1975), N.Jaffe и др. (1977), S.A.Rosenberg и др. (1979), как и работы последующих лет, в том числе и отечественных авторов (Н.Н.Трапезникова, Л.А.Еремина и др.), показывают, что можно часть больных вылечить и продлить жизнь другим, комбинируя оперативное удаление метастазов легких с химиотерапией. Описаны наблюдения, когда излечения добивались после 3 операций — резекций легких, произведенных в течение 2—4 лет.
С 1966 г. мы начали применять сохранные операции у больных с остеогенными (и другими) саркомами. Нами были предложены эндопротезы для замещения верхнего отдела плечевой кости, всей плечевой кости, предложены модификации протеза Сиваша—Соколова для тазобедренного сустава (1969 г.), комплекс для замещения всей бедренной кости с тазобедренным и коленным суставом, который изготавливался за 4 рабочих часа и мог быть использован на следующий день для замещения верхнего конца большеберцовой кости и еще нескольких более мелких суставов (см. Аллопластика, Эндопротезирование).
Поскольку у нас в клинике было разработано эндопротезирование, мы с начала 70-х годов стали работать совместно со специалистами Онкологического научного центра им. Н.Н.Блохина — акад. Н.Н.Трапезниковым, проф. Л.А.Ереминой, акад. Ю.Н.Соловьевым, акад. Л.А.Дурновым, чл.-кор. Н.Е.Кушлинским, докт.мед.наук П.А.Симаковым, проф. В.Н.Бурдыгиным и М.Д.Алиевым.
Наша клиника помогала внедрять методы сохранных операций. Специалисты Онкологического научного центра им. Н.Н.Блохина под руководством Н.Н.Трапезникова изучали биохимические изменения в организме больных с остеогенной саркомой, проводили неоадъювантную химиотерапию, морфологические изменения в опухоли, адъювантную терапию. С 1979 г. Н.Н.Трапезниковым, Ю.Н.Соловьевым, Н.Е.Кушлинским, Л.А.Дурновым, Н.А.Синюковым, М.Д.Алиевым и др. исследовалось значение биохимических и эндокринологических показателей у 268 больных во втором десятилетии с остеогенной саркомой и другими злокачественными опухолями. Было выявлено, что для остеогенной саркомы характерна полная утрата полисиалоганглиозидов, для хондросаркомы — самые высокие уровни дисиалоганглиозидов, для опухоли Юинга — преобладание GDI (дублетный), для злокачественной фиброзной гистиоцитомы — специфический GMY (выявленный только в саркоме кости) и для гигантоклеточной опухоли — одинаковые количества СМз и О0з (синглетный) ганглиозидов.
Эти данные, впервые полученные сотрудниками РАМН, дают возможность создать новое направление в диагностике и дифференциальной диагностике различных морфологических вариантов сарком костей и в первую очередь остеогенной саркомы. Морфологами подтверждено, что при хондробластическом варианте остеогенной саркомы легочные метастазы малочувствительны к химиотерапии.
Н.Е.Кушлинским и др. была показана эндокринная зависимость остеогенной саркомы: так, концентрация инсулиноподобного фактора роста I типа в плазме больных возрастала с увеличением активности роста опухоли. По данным авторов, остеогенные саркомы содержат цитоплазматические рецепторы андрогенов в 56 % и эстрогенов — в 52 % случаев, и впервые было показано, что наличие цитозольной фракции остеогенной саркомы (рецепторов андрогенов) является неблагоприятным прогностическим фактором. В исследованиях последних лет доказано, что одним из путей ухода опухолевых клеток из-под рострегулирующего контроля организма может быть продукция ими или окружающими стромальными клетками полипептидов, стимулирующих пролиферацию, — так называемых аутои паракринных факторов роста. Эпидермальный и трансформирующие факторы роста относятся к аутои паракринным регуляторам. Н.Е.Кушлинский пришел к мнению, что остеогенная саркома у человека — опухоль, гормоночувствительная к андрогенам, которые имеют связь с ее патогенезом. Очевидно, возможна и необходима разработка эндокринологических методов лечения больных с остеогенной саркомой.
Большую роль играют простагландины Е и F2a . Эти важнейшие биохимические исследования позволяют проводить дифференциальную диагностику, судить об интенсивности роста, появлении метастазов, об эффективности неоадъювантной и адъювантной (преди послеоперационной) терапии. Несомненно, что разработка эффективных режимов химиотерапии связана с созданием высокоактивных противоопухолевых препаратов и профилактическим подходом, когда выбор основного химиотерапевтического препарата для послеоперационной химиотерапии определяется его эффективностью в отношении первичной опухоли.
Глубину регрессии опухоли после проведения неоадъювантной терапии принято подразделять на 4 степени:
• I степень — после химиоили лучевой терапии отмечался незначительный эффект (или эффекта не было);
• II степень — около 50 % ткани опухоли некротизировалось;
• III степень — более 90 % опухоли некротизировалось;
• IV степень — полное отсутствие жизнеспособности опухоли.
Если профилактическая терапия позволила добиться III—IV степени воздействия на опухоль, то в послеоперационном периоде продолжается лечение этим же препаратом; если эффект лечения слабый, то химиотерапия (адъювантная) проводится другими препаратами.
С 1968 г. в ОНЦ им. Н.Н.Блохина под руководством Н.Н.Трапезникова было начато целенаправленное исследование.
Неадъювантная химиотерапия проводилась в трех основных режимах, каждому из которых соответствовали следующие показания. Предоперационная химиотерапия: первый режим — внутриартериальная инфузия цисплатина (платидиама) в дозе 150 мг/м2 в течение 3 ч. В зависимости от ответа опухоли, который контролировался клинически, рентгенологически (ангиография, компьютерная томография) и сканографически, больные получали от 2 до 6 курсов химиотерапии с интервалом 3—4 нед, после чего им выполняли операцию. Вторая схема подразумевала использование метотрексата высокими дозами (8—12 г/м2 ) под защитой лейковорина в виде 2— 3 курсов с интервалом 2—3 нед. Третий режим включал внутриартериальное введение адриамицина в дозе 30 мг/м2 в сутки в течение 3 дней. В зависимости от ответа опухоли больные получают 1—2 курса с интервалом 3—4 нед.
Хирургическое вмешательство. При отсутствии осложнений через 3—4 нед после окончания очередного курса химиотерапии выполняли хирургический этап лечения. Объем операции зависел от степени местного распространения первичной опухоли. Сохранные операции в виде широкой сегментарной резекции кости выполняли при ограниченных поражениях без вовлечения в опухолевый процесс магистральных сосудов и окружающих мягких тканей. При показаниях были вынуждены прибегать к более расширенным операциям типа ампутаций или экзартикуляций.
1. Если при применении внутриартериальной инфузии препаратов платины достигался выраженный эффект (степень повреждения опухоли составляла 90 % и более), то дополнительная химиотерапия включала: внутривенную инфузию цисплатина (платидиама) в дозе 30—40 мг/м2 в 1—3-й дни цикла или 100 мг/м2 однократно на фоне поддерживающей гипергидратации и форсированного диуреза; внутривенное введение адриамицина — 40—50 мг/м2 в первый день и циклофосфана в дозе 500—600 мг/м2 во 2-й день (схема САР). В зависимости от переносимости лечение состояло из 6 курсов с интервалом 4 нед. При незначительных проявлениях лекарственного патоморфоза назначали адъювантную химиотерапию адриамицином.
Препарат вводили внутривенно по 30 мг/м2 в течение 3 дней. Интервалы между циклами составляли 3—4 нед, всего проводили 6 курсов. Показатель 4-летней выживаемости без признаков заболевания при III—IV степени повреждения опухоли после внутриартериальной инфузии цисплатина составил 74,1 % (больные с IV степенью повреждения наблюдались в этот срок без каких-либо признаков основного заболевания). Представленный показатель в 5 раз достоверно превышал аналогичные данные в группе больных, получавших хирургическое лечение (р<0,001). При лечении больных остеогенной саркомой детей уровни 4и 5-летней выживаемости равны и составляют 52,5 % (р<0,05).
2. Если при применении в предоперационном периоде высоких доз метотрексата с лейковорином отмечался выраженный эффект, то адъювантная химиотерапия включала: внутривенную инфузию метотрексата дозами по 8 мг/м2 под защитой лейковорина в виде 3 курсов с интервалом 3 нед, чередующихся с введением адриамицина по 30 мг/м2 в течение 3 дней (3 курса с аналогичным интервалом). В альтернативной ситуации использевалась схема САР. После предоперационной химиотерапии высокими дозами метотрексата с лейковорином показатель 4-летней безметастатической выживаемости составил 33,3 %.
3. Если применение в предоперационном периоде внутриартериальной инфузии адриамицина сопровождалось значительным повреждением первичной опухоли, поддерживающую химиотерапию проводили по схеме САР.
Послеоперационную (адъювантную) химиотерапию начинали на 12— 14-й день после операции, т.е. к моменту заживления раны, и проводили с использованием 3 режимов лечения.
1. Больным первой группы назначали многокомпонентную программу с включением препаратов различного механизма действия: адриамицин, циклофосфан, винкристин, сарколизин. Лечение продолжали в течение 76 дней по следующей схеме: адриамицин по 0,75 мг/кг в 1-й, 3-й, 6-й, 18-й, 21-й и 24-й дни; по 0,5 мг/кг в 36-й, 37-й, 54-й и 55-й дни лечения; циклофосфан — по 5 мг/кг ежедневно в течение 7 дней тремя курсами; винкристин вводили по 0,025 мг/кг один раз в 7 дней на протяжение 76 дней (всего 12 раз); сарколизин — по 0,3 мг/кг на 30-й, 42-й, 60-й и 72-й дни лечения. В среднем на курс лечения больные получали 260—390 мг адриамицина, 12—20 мг винкристина, 3700—5900 мг циклофосфана и 60—80 мг сарколизина.
Основной показатель эффективности адъювантной химиотерапии — время появления метастазов. Изучение отдаленных результатов показало, что в группе больных, получавших адъювантную химиотерапию, 5 лет без метастазов прожили 30,5 % больных, тогда как только при хирургическом методе этот показатель составил 7 %. Дополнительная химиотерапия улучшает результаты более чем в 3,5 раза (р,05).
2. Во второй группе проводили адъювантную химиотерапию адриамицином. Препарат вводили внутривенно по 30 мг/м2 в течение 3 дней. Интервалы между циклами составили 3—4 нед, всего проводили 6 курсов. Изучение отдаленных результатов показало, что в течение 5 лет без метастазов прожили 53,2 % больных (р,001). У детей этот показатель несколько ниже — 36,8 % (р,05).
3. В третьей группе адъювантная химиотерапия (схема САР) включала: внутривенную инфузию цисплатина (платидиама) в дозе 30—40 мг/м2 в 1 — 3-й дни цикла на фоне поддерживающей гипергидратации и форсированного диуреза, внутривенное введение адриамицина по 40—50 мг/м2 в первый день и циклофосфана в дозе 500—600 мг/м2 во 2-й день. В зависимости от переносимости лечение состояло из 6—9 курсов с интервалом 4 нед. Больные с 5-летней выживаемостью без метастазов в этой группе составили 45,5 % (р<0,001).
Таким образом, проведенное исследование показало, что при любой из схем адъювантной (профилактической) химиотерапии показатели выживаемости без метастазов были в 3—4 раза достоверно выше, чем при чисто хирургическом вмешательстве.
Таковы блестящие достижения современного лечения в ОНЦ им. Н.Н.Блохина, проводимого группой под руководством академика Н.Н.Трапезникова.
Проведенные в ОНЦ исследования по лечению множественных метастазов остеогенной саркомы в легких по двум основным программам показали следующее.
1. В первой группе больных химиотерапию применяли по схеме САР: платидиам по 30—40 мг/м2 в 1—3-й дни, адриамицин — по 400—600 мг/м2 на 2-й день у 62 больных с множественным поражением легких. Ранее эти больные получали комбинированное лечение, включающее радикальные операции различного объема, в том числе и резекции кости с замещением дефекта аллокостью или эндопротезом; у большинства из них проводили преди послеоперационную химиотерапию с использованием адриамицина. Эффект лечения отмечен у 30,8 % больных.
2. Во второй группе больных из 34 человек также с множественными метастазами использовали метотрексат в дозах от 300 мг/м2 до 8 г/м2 с лейковорином (метастазы у больных возникли после радикального удаления первичной опухоли вскоре или на фоне адъювантной химиотерапии с использованием антрациклинов или производных платины). Эффект лечения отмечен у 20,6 % больных.
Применяются и другие схемы полихимиотерапии. Изучение представленных программ показало, что повышение эффективности терапии метастазов остеогенной саркомы в легких возможно путем комбинации лекарственного лечения и хирургического вмешательства.
Следует отметить, что под влиянием современной химиотерапии несколько изменились биологические особенности данной опухоли. Если раньше, по данным Онкологического научного центра им. Н.Н.Блохина, преобладали множественные метастазы, а солитарные и единичные опухоли составляли 9,9 %, то теперь на фоне адъювантной химиотерапии указанный характер поражения отмечен в 64 % наблюдений. В настоящее время наличие солитарного или единичных метастазов опухоли в легких представляет ту клиническую ситуацию, когда существует возможность оказать больному реальную помощь.
Программа терапии следующая: 1) предоперационная химиотерапия; 2) оценка эффективности лечения; 3) хирургическое лечение; 4) гистологическая оценка лекарственного патоморфоза; 5) послеоперационная поддерживающая (адъювантная) химиотерапия.
Предоперационная химиотерапия. Лечение наиболее часто начинали с химиотерапии по схеме САР: платидиам по 30—40 мг/м2 в 1—3-й дни; адриамицин по 40—50 мг/м2 на 2-й день. Реже применяли высокие дозы метотрексата — от 2,5 до 3,5 г/м2 — с лейковорином. В обоих случаях проводили 2 курса химиотерапии. После операции — адъювантная химиотерапия. Следует отметить, что полихимиотерапия может проводиться только специалистами высокого класса.
К сожалению, ортопедам, занимающимся костной патологией и разрабатывающим сохранные операции, выпадает тяжелая миссия оперировать тех больных с остеогенной саркомой, которым онкологи не нашли возможным в комплексном лечении предложить резекцию и настаивали на ампутации, от которой больные отказывались. Однако существует определенная группа больных с остеогенной саркомой, у которых нет первичного поражения легких и метастазы развиваются не в первые годы после операции. Именно эта группа больных должна представить предмет особого всестороннего изучения специалистов.
Больная Б-ва, 16 лет, обратилась в больницу Ярославля по поводу болей и припухлости в верхней трети левой голени.
12.VII.88 г. произведена открытая биопсия. Направлена в ВОНЦ АМН СССР, где был поставлен диагноз остеогенной саркомы и рекомендована ампутация бедра. Больная отказалась от операции и обратилась в отделение костной патологии взрослых ЦИТО, где была произведена резекция единым блоком верхнего конца большеберцовой кости с верхним концом малоберцовой кости, окружающими тканями, капсулой коленного сустава и менисками.

Рис. 26.1. Телеангиэктатическая саркома верхнего конца большеберцовой кости у больной М., 17 лет. а — опухолевая деструкция на внутренней поверхности большеберцовой кости; б — для снижения внутрикостного давления через кортикальный слой к нижнему концу ножки эндопротеза введена канюля. Боли при ходьбе исчезли. Через 14 лет больная здорова.
Дефект замещен эндопротезом из метилметакрилата на титановой ножке, введенным в костномозговую полость большеберцовой кости (эндопротез С.Т.Зацепина). При нагрузке на ногу появлялась незначительная боль, обусловленная поршневыми движениями и повышением давления в костномозговом канале (рис. 26.1). Чтобы снизить давление, мы просверлили кортикальный слой кости на уровне конца титановой ножки и ввинтили трубочку, которая обеспечила сообщение жидкости костномозгового канала и мышечного пространства. Боли исчезли.
На распиле во фронтальной плоскости: часть эпифиза, большая часть метафиза и часть костномозгового канала диафиза занимают очаг неправильной формы, размерами 8,5x5x4 и 4x4x3 см. Над метафизом с внутренней стороны кости на площади 5x4 см кортикальная пластинка кости разрушена. Основной объем очага представлен множественными кистами диаметром от 0,5 до 2,5 см, заполненными жидкой кровью. Перегородки между кистами тончайшие, просвечивающие. Самый наружный прилегающий к окружающей костной ткани слой очага (он имеется только местами) представлен мягкой розовой тканью, толщина которой колеблется от 0,2 до 1,5 см. Наибольшей ширины — 1,5 см — эта ткань достигает в зоне, где костная кортикальная пластинка разрушена.
Заключение: опухоль имеет строение остеогенной саркомы — телеангиэктатический вариант.
Консультирована в ВОНЦ: нуждается в наблюдении; химиотерапия будет проведена в случае появления метастазов. Больная здорова в течение 13 лет. Окончила школу и институт, работает, ходит без палочки, танцует.
Это один из редких случаев, когда при телеангиэктатическом варианте остеогенной саркомы получен благоприятный исход оперативного лечения.
Второй больной — с полиоссальной формой фиброзной дисплазии: телеангиэктотическая саркома развилась в правой бедренной кости, которая несколько раз подвергалась операции и вытяжению с целью удлинения. Произведена межподвздошно-брюшная ампутация. Больной жив 19 лет.
С.Т.Зацепин
Костная патология взрослых
Комментировать:
Похожие статьи:
Удаление гигантских доброкачественных и некоторых злокачественных опухолей крестца
Категории: Костная патология, Лечение при опухолях костей,
Доброкачественные опухоли крестца, особенно неврогенного происхождения — неврилеммомы, нейрофибромы, достигают иногда очень больших, даже гигантских размеров. Они смещают кверху и деформируют мочевой..
Удаление опухолей крестца
Категории: Костная патология, Лечение при опухолях костей,
Рис. 43.14. Тератома крестца. а разрушены III, IV, V крестцовые позвонки — тератома удалена. Метастазы рака в крестце выявлены у 72 пациентов (или 8 %) из 908 оперированных с метастатическими..
Паразитарные и грибковые заболевания костей
Категории: Костная патология, Дисплазии и опухоли костей,
Альвеококкоз и эхинококкоз Частота поражения костей эхинококковом и альвеококкозом на большом материале не исследована и в доступной нам литературе не представлена. К сожалению, то же произошло и с..
Нейрогенные опухоли костей
Категории: Костная патология, Дисплазии и опухоли костей,
Нейрогенные опухоли костей — неврилеммомы и нейрофибромы, как доброкачественные, так и особенно злокачественные, редко встречаются у больных, и даже в специализированных учреждениях и отделениях костной..

