Учебные материалы
Конектбиофарм
Работа
Компании
Реклама от Google
Активация свертывающей системы и образование тромба при введении имплантатов
Образование сгустка крови вокруг имплантата после оперативного введения является одной из первых реакций организма. Имеется много гипотез, связывающих гемосовместимость биоматериалов с той или иной характеристикой их поверхности. Предполагается, что это обусловлено зарядом, селективной адсорбцией белков, гидрофильно-гидрофобными свойствами, свободной энергией, ионогенностью, микрогетерофазностью этих поверхностей. Однако эти гипотезы, как справедливо отмечает Барбараш с соавт. (1995), часто противоречивы и не подтверждаются однозначными экспериментальными данными.
Обычно пусковым механизмом является контакт с чужеродной поверхностью и(или) повреждение эндотелиальной стенки сосудов, протекающие с выделением XIIа фактора Хагемана, который включает классический внутренний механизм свертывания крови. По-видимому, в данном процессе большую роль играет межфазная свободная энергия на поверхности раздела биоматериал/кровь. Она зависит от природы материала, содержания и организации в нем воды, межфазного электрического потенциала и гидрофильно-гидрофобного баланса (Шумаков, 1990; Барбараш и др., 1995). Другой альтернативный (наружный) путь включения фиброгенеза осуществляется через фосфолипиды, тканевые факторы в присутствии ионов кальция через VII фактор. Оба пути приводят к активации X фактора. Еще одним механизмом может быть продукция контактирующими с коллагеном тромбоцитами V фактора. В любом случае из протромбина образуется тромбин, который конвертирует фибриноген в фибрин с образованием тромба. К образующейся плотной фиброзной прокладке прикрепляется все больше тромбоцитов и других клеток крови, постепенно закрывающих дефект тканей (Баркаган, 1985).
Агрегация тромбоцитов протекает в три стадии - адгезия, начальная и вторичная агрегация. Первоначально происходит адгезия тромбоцитов, где активную роль играют коллаген, гликопротеин Ib, ионы кальция, фактор Виллибранда, адсорбированные на имплантатах. Причем тромбоциты прикрепляются к коллагену, расположенному под эндотелиальной соединительной тканью. Эта адгезия вызывает активацию и начальную агрегацию тромбоцитов с выделением АДФ и тромбоксана А2. При этом кальцийзависимый трансмембранный гликопротеин IIb-IIIa, плазменный фактор I, связывается с фибриногеном. Происходит активация тромбоцитов, они изменяют свою форму, секретируют содержимое своих гранул, метаболиты арахидоновой кислоты и цитокины. Освобождение тканевого фактора и контактная активация факторов свертывания принимают участие во внешней и внутренней коагуляции, затем происходит образование тромбина, превращение фибриногена в фибрин, образование тромбоцитарного тромба (Баркаган, 1985; Севастьянов, 1999; Gunkemeier et al., 1988).
При экспозиции крови с титановыми сплавами, равно как и с другими металлами, происходит адгезия тромбоцитов и лейкоцитов к материалу. Причем уровень адгезии этих клеток зависит от качества обработки поверхности металла. К более шероховатым поверхностям тромбоциты и лейкоциты прикрепляются достоверно выше, чем к гладким (Nygm, 1998).
Биологическим смыслом процесса тромбообразования является борьба с локальной кровопотерей, заполнение образовавшихся дефектов пластическим материалом, подготовка тканей к запуску следующей стадии воспаления.
Предполагается, что материалы, повышающие адгезию тромбоцитов, способствуют и(или) ускоряют процесс образования сгустка крови (Grunkemeier et al., 1998).
С активацией ХIIа фактора, который является протеазой, связан не только запуск гемостаза, но и накопление плазменных медиаторов воспаления, В первую очередь, речь идет об активации системы комплемента, в которой участвует более 20 белков. Ключевым моментом в активации комплемента является расщепление третьего компонента С-С3 на два основных -С3a и С3b фрагмента под действием С3-конвертазы. В свою очередь, взаимодействие С3b с С3 конвертазой приводит к образованию С5 конвертазы, которая расщепляет С-С5 на С5a и С5b. Следует подчеркнуть, что запуск каскадной реакции активации комплемента может происходить еще по двум путям, через эндотоксины и микробные продукты или иммунные комплексы. Результатом этого процесса является образование С5689 комплекса, который обладает мембраноповреждающим действием, разрушающим клетку (Маянский, Маянский, 1989; Jose, 1987). Биоактивные материалы могут модифицировать белки, адсорбирующиеся на их поверхности за счет высвобождающихся из них в процессе деградации молекул и ионов. В результате могут образовываться аутоиммунные комплексы с участием IgM и IgG, которые, в свою очередь, могут запускать каскадный механизм активации комплемента. Другой путь лежит через сорбцию биоматериалами микроорганизмов, липополисахаридов, эндотоксинов, иммуноглобулинов с последующим включением пути Б и В. Классический путь идет через иммунные комплексы (путь А), альтернативный - через действие эндотоксина и других продуктов микроорганизмов (путь Б), прямого ограниченного протеолиза фракции С3 (путь В). Биоматериалы могут включать все три пути активации комплемента за счет образования аутоиммунных комплексов, адсорбции на своей поверхности микроорганизмов, эндотоксинов, активации протеаз и конвертаз (Севастьянов, 1999; Thull, 1992, 1994).
Фактор ХIIа вместе с другими ферментами инициирует накопление в плазме еще одних медиаторов воспаления - кининов. Они образуются из плазменного предшественника калликрининогена, трансформирующегося из прокалликреина (Regoli, 1987). Кининогены, калликреины, кинины и кининазы составляют калликреин-кининовую систему.
Один из представителей кининов - брадикинин повышает проницаемость сосудов, вызывает отек, боль. Кинины индуцируют повышение сосудистой проницаемости в период 1,5-2,5 часов после воспроизведения воспаления вслед за гистамином и серотонином, уступая затем место простагландинам (Di Rosa et al., 1971).
Все вышеперечисленные факторы (факторы свертываемости крови, система комплимента и калликреины) относятся к гуморальным медиаторам воспаления. Другая группа медиаторов относится к клеточным медиаторам. Часть из них находится в проактивной форме, другая - вновь синтезируется (Anderson, 1982). Среди них выделяют вазоактивные амины - гистамин, серотонин, лизосомальные факторы (протеазы, гидролазы, неферментные катионные белки), нейропептиды (кальцитонин, ген-связанный пептид, нейрокинин А), производные арахидоновой кислоты или эйкозиноиды (простагландины, тромбоксаны, лейкотриены, гидрооксикислоты), цитокины (интерлейкины, хемокины), кислород-производные (супероксиданион, радикал гидроксила, пергидроксил, синглетный молекулярный кислород, перекиси водорода) (Чернух, 1979; Маянский, Маянский, 1989; Дыгай, Клименко, 1992; Гомазков, 1995; Nicola, 1995).
В результате мобилизации тромбоцитов и активации гемостаза в ране образуется сгусток крови, который сокращается, а плазма всасывается окружающей тканью. Затем, через 4-6 часов в поврежденную ткань мигрируют гранулоциты и начинается стадия инфильтрации воспалительной реакции. При неосложненном процессе через 12-24 часа в ране скапливается новая популяция мигрантов - мононуклеарные фагоциты и лимфоциты, которые постепенно вытесняются фибробластами и специализированными тканевыми клетками (остеобластами, остеоцитами, эндотелием и остеокластами). Они обеспечивают замещение дефекта новой тканью (Маянский, Урсов, 1997; Севастьянов, 1999).
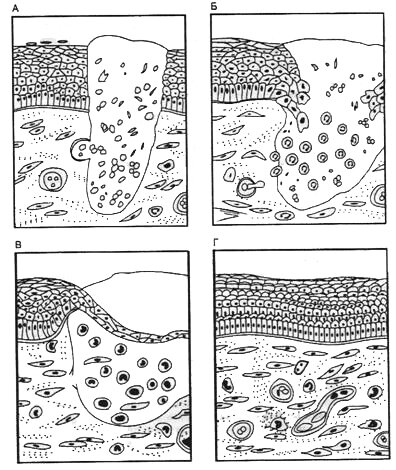
Главные стадии заживления раны (Маянский, Урсов. 1997). А - мобилизация тромбоцитов и гемостаз; Б - инфильтрация раны гранулоцитами (полиморфоядерными нейтрофилами); В - поступление в рану мононуклеарных клеток (лимфоцит, моноцитов-макрофагов, фибробластов); Г - пролиферация фибробластов, специализированных клеток и замещение дефекта новой тканью
Параллельно с первой стадией воспаления развивается следующая фаза, называемая экссудацией, обусловленная выбросом вазоактивных медиаторов - гистамина, серотонина, затем брадикинина и простагландинов. В результате развиваются нарушения в микроциркуляторном русле, которые начинаются с рефлекторного спазма сосудов, вызванного гистамином и серотонином, который затем сменяется расширением всей сосудистой сети зоны воспаления, постепенным развитием стаза и нарушения реологических свойств крови. Происходит выход жидкой части плазмы в тканевое пространство с формированием отека. Белки отечной жидкости обладают способностью к связыванию токсических агентов, задерживанию их всасывания в кровь и распространения по организму, т.е. выполняют барьерную функцию. Рассасывание отечной жидкости осуществляется преимущественно через лимфатическую систему (Чернух, 1979; Gallin et al., 1992).
Учитывая вышесказанное, биоматериалы необходимо тестировать на их способность вызывать дегрануляцию тучных клеток, с выделением гистамина и серотонина. Если такая реакция происходит, то имплантат потенциально является провоспалительным агентом и возможность использования его в практике существенно ограничена. Самым простым тестом является тест по дегрануляции тучных клеток, выделенных из перитонеальной полости лабораторных крыс или мышей.
Для этого крысе, после дачи наркоза, внутрибрюшинно вводят 10-15 мл (мыши - 2-5 мл) сбалансированного фосфатным буфером физиологического раствора (СФР) (рН=7,2—7,4), содержащего 50 ЕД/мл гепарина. Осторожно массируют брюшную стенку. Через 10-15 мин перитонеальный экссудат осторожно собирают с помощью шприца, предварительно промытого гепарином. Жидкость разделяют на две части. К одной части добавляют вытяжку из биоматериала (от 5 до 50% по объему). В ряде случаев можно осуществить прямую инкубацию тестируемого материала с клетками. При этом общая площадь рабочей поверхности должна составлять от 2 до 5 см2. Образцы оставляют при 37 °С на 45-60 мин в силиконизированной пробирке или чашке Петри. В контроле добавляют эквивалентный вытяжке объем СФР. Затем к 1 мл экссудата вносят 1мл 0,5% раствора нейтрального красного, приготовленного на СФР, помещают в камеру Горяева и микроскопируют при увеличении х200-400.
Тучные клетки выглядят в виде черных или темно-коричневых клеток в форме «клякс», содержащих большое количество мелких гранул. После дегрануляции в тучных клетках становится видно крупное округлое ядро, цитоплазма коричневая или розовая. Подсчитывают индекс дегрануляции (ИД) тучных клеток (на 50-100 тучных клеток) по формуле:
Ид = (ОЧТК-ДТК)/ДТК х100%,
где ОЧТК - общее число тучных клеток, ДТК - количество дегранулированных тучных клеток.
А.В. Карпов, В.П. Шахов
Системы внешней фиксации и регуляторные механизмы оптимальной биомеханики

