Учебные материалы
Конектбиофарм
Работа
Компании
Реклама от Google
Сосудистые опухоли костей
Категории: Костная патология, Дисплазии и опухоли костей,
Сосудистые опухоли костей возникают в результате увеличения количества сосудов практически нормального строения и разрастания клеток сосудистого эндотелия, ангиобластов, приобретших патологические опухолевые свойства, которые настолько разнообразны, что строго дифференцировать сосудистые опухоли на группы очень сложно.
По данным ВОЗ, сосудистые опухоли подразделены на 3 группы:
1) доброкачественные; 2) неопределенные, или промежуточные; 3) злокачественные.
Доброкачественные опухоли — гемангиомы — чаще всего встречаются в позвонках, иногда в двух, трех, четырех. Длительное время они могут ничем себя не проявлять, затем появляются боли, которые с трудом поддаются лечению. Диагноз ставят на основании рентгенологической картины, особенно при использовании КТ. Длительный опыт показал, что применяемое лучевое лечение малоэффективно. Гемангиомы могут быть венозные, артериовенозные и артериальные или преимущественно артериовенозные. Возможны попытки лечения путем эмболизации сосудов опухоли гемангиомы позвоночника, но это можно попытаться делать, лишь имея большой опыт работы в специализированных отделениях.
Попытка произвести частичную резекцию тела позвонка и фиксацию может вызвать профузное кровотечение, которое очень трудно остановить.
На всю жизнь запомнился больной 27 лет с резкими болями в нижнегрудном отделе позвоночника и рентгенологической картиной, указывавшей на резкие изменения в телах VIII, IX, X грудных позвонков. Во время операции после резекции ребер с двух сторон мы (оперировал проф. А.И.Казьмин) увидели пульсирующее округлое образование, диаметр которого оказался гораздо больше диаметра позвоночника на этом уровне. Было выполнено единственное, что возможно: вдоль пульсирующей ангиомы позвоночника уложено и фиксировано к ребрам 4 широких, длинных, гладких консервированных аллотрансплантата, наложены швы на мышцы, кожу. Через 6 мес, когда сняли гипсовый корсет, больной отметил уменьшение болей, увеличение устойчивости, через 1,5 года мог свободно проходить 10— 15 км, не испытывая боли, охотясь за зайцами.
Клинически очень демонстративен пример с больным К., 18 лет, поступившим с большой опухолью средней трети правой бедренной кости и сросшимся переломом в этой области (рис. 30.1). Больной от операции решил воздержаться. Приехал через 2,5 мес, когда опухоль резко увеличилась. Произведена экзартикуляция бедра. Микроскопический диагноз: гемангиоэндотелиома. Через 4 мес наступил патологический перелом тела I поясничного позвонка — метастаз опухоли. Нужно помнить, что даже после сегментарной резекции возможны рецидивы через 17 лет и более. Всего мы наблюдали 14 больных с гемангиоэндотелиомой.
Гемангиоперицитома встречается реже; под нашим наблюдением находилось 4 больных: двое с поражением верхнего конца бедренной кости; у одной больной в возрасте 21 года внезапно наступил патологический перелом, и ее доставили из окнологического учреждения, поскольку она отказалась от экзартикуляции в тазобедренном суставе У четвертого больного с поражением лопатки произведены экстирпация лопатки и замещение эндопротезом; отмечено практически полное восстановление функции руки.
Двум первым больным были произведены обширные резекции верхнего конца бедренной кости, при операциях наблюдалась повышенная кровоточивость окружающих нормальных на вид мышечных тканей. Осуществлено эндопротезирование; в течение 2 лет больные получили по 6 курсов лечения циклофосфаном. Здоровы, при ходьбе прихрамывают, на улице ходят с палочкой — отдаленный результат 27 лет.
Вывод, который мы можем сделать на основании собственного опыта лечения больных с гемангиоэндотелиомами и гемангиоперицитомами:
1) опухоли необходимо удалять абластично, оставляя на опухоли слой здоровых тканей;
2) возможно производить сохранные операции с применением эндопро-! тезов.
Однако прогнозировать результат лечения очень трудно или невозможно.
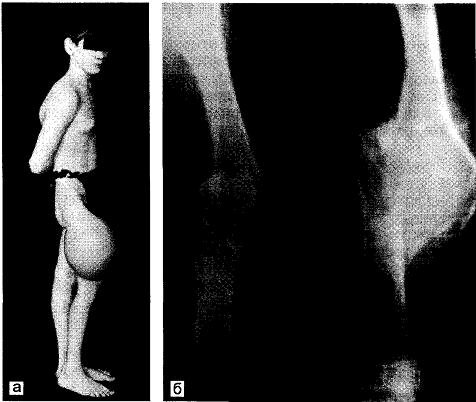
Рис. 30.1. Злокачественная сосудистая опухоль бедренной кости. а — ткань костной мозоли благодаря отсутствию «памяти формы» растягивается, но не ломается; б — рентгенограммы.
Ангиосаркомы
Наблюдали 12 больных, 7 из которых умерли в разные сроки после операции; у 2 пациентов при сохранных операциях наблюдались рецидивы, по поводу которых они были повторно оперированы. Судьба больных после операций неизвестна.
Развитие опухолевого процесса, очевидно, бывает очень стремительным. Так, у больного 55 лет была обнаружена опухоль правой половины таза, которая, судя по анамнезу, быстро росла. При обследовании грудной клетки — легкие прозрачные, без очаговых изменений. Произведена межподвздошно-брюшная ампутация. При обследовании через 3 нед в легких выявлено много довольно крупных метастазов.
Сосудистые опухоли — это опухоли, локализующиеся в костях; опухолевой трансформации со стороны костной ткани не наблюдается. Сравнительно часто встречаются венозно-кавернозные опухоли в верхнем завороте коленного сустава. Если такому больному на бедро наложить слегка натянутый жгут и опустить ногу вниз, едва пальпируемое образование резко увеличится и станет более плотным. При этом можно считать, что диагноз подтвержден.
Однако мы наблюдали ангиосаркому, которая покрывала синовиальную оболочку всего верхнего заворота, имела ярко-красную окраску, что отличало ее от пигментно-виллезно-нодулярного синовита.
Гломусные опухоли
Гломусные опухоли имеют обычно небольшие размеры, сферическую форму в виде узелка и поэтому называются гломусными (glomus — шар). Они могут располагаться во всех тканях человеческого тела, кроме головного мозга. Опухоль состоит из сети анастомозирующих синусоидальных сосудов, снова переходящих в артериальный ствол. Между этими сосудами располагаются рецепторные клетки, являющиеся основой опухоли. Как пишет Е.В.Уранова (1971), гистогенетические гломусы представляют собой дериваты элементов ганглионарной пластинки и закладок парасимпатической системы.
К нехромаффинным параганглиям (гломусам) относят: артериальные, каратидные, югулярные, интравагинальные, пульмональные узелки, узелки по ходу артериальных и венозных стволов конечностей, надкостницы, костного мозга, поперечнополосатой мускулатуры и т.д.
Гломусная опухоль впервые описана в 1876 г. русским врачом Г.Ф.Гобером. Выделяют следующие виды гломусных опухолей:
• обычный тип, характеризующийся альвеолярным и альвеолярно-трабекулярным строением;
• аденомоподобный тип;
• ангиомоподобный тип;
• компактный тип;
• злокачественные варианты.
Наиболее часто встречается опухоль ногтевых фаланг пальцев, чаще под ногтевой пластинкой, через которую просвечивает в виде красноватого или синюшного образования размером 5x7 или 3x12 мм, резко болезненного при надавливании или изменении температуры льющейся на палец струи воды. Ногтевая пластинка над этим образованием часто деформирована, а на рентгенограмме может обнаруживаться дефект ногтевой фаланги. Эти опухоли известны как опухоли Барре—Массона (по именам описавших их авторов) [Barre J., Masson P., 1924].
Лечение только оперативное: под проводниковой анестезией снимают ногтевую пластинку или резецируют часть ее; опухоль, покрытая соединительнотканной оболочкой, легко удаляется. При правильно проведенной операции рецидивы крайне редки.
При разрушении костей черепа, позвоночника и т.п. диагноз, как и оперативное вмешательство, значительно труднее.
Мы наблюдали более двух десятков больных с поражением ногтевых фаланг; в одном случае поражение было симметричным.
Саркома Юинга
Саркома Юинга — очень злокачественная опухоль костей, встречающаяся сравнительно редко. Эта опухоль была выделена Джеймсом Юингом в 1921 г. По мнению Т.П.Виноградовой, раньше она относилась к круглоклеточным саркомам костей. Юинг назвал ее эндотелиомой, а затем многочисленные исследователи относили ее к разным группам опухолей. Этот сложный вопрос до настоящего времени дискутируется. Н.А.Краевский и Б.П.Тарасов включали ее в группу злокачественных гемангиоперицитом.
Б.П.Тарасов практически был согласен с мнением Юинга, подразделяя опухоль на три варианта в зависимости от строения. Подобную же точку зрения высказывала в 1973 г. Т.П.Виноградова, признававшая существование разновидностей саркомы Юинга, исходя из ее микроскопического строения и давшая микроскопическое описание двух из них. Гистогенетический источник опухоли Юинга не установлен, предполагалось ее происхождение из недифференцированных ретикулярных клеток, а также миелогенном, гистиоцитарном, мезенхимальном, ангиогенном происхождении.
Л.В.Литвинова, Ю.Н.Соловьев (1982) в результате электронно-микроскопического исследования пришли к мнению, что опухоль состоит из низкодифференцированных клеток, в которых обнаружены: умеренно развитый ШЭР, аппарат Гольджи, микрофибриллы, лизосомы, пиноцитозные везикулы, псевдоподии, базальные мембраны; клетки формируют единичные тубулярные структуры. Эти данные подтверждают, по мнению авторов, предположение об ангиогенной принадлежности клеток опухоли. Дифференциальный диагноз иногда сложен, его приходится проводить с ретикулосаркомой, метастазами нейробластомы и другими опухолями. В отличие от ретикулосаркомы в саркоме Юинга отсутствуют в определенном порядке расположенные ретикулярные волокна. По данным Ф.Шайовича, в клетках саркомы Юинга имеется гликоген, тогда как в нейробластоме и ретикулосаркоме он отсутствует. У больных с нейробластомой увеличено выделение катехоламинов с мочой.
По D.C.Dahlin (1978), саркома Юинга составляет 6 % в группе злокачественных опухолей костей. F.Schajowicz (1981), наблюдавший 210 больных с саркомой Юинга, говорит о 9,17 %; по данным ВОНЦ, 230 больных, находившихся там на лечении, составляли 25,8 %, однако, очевидно, правы Н.Н.Трапезников, Л.А.Еремина (1985), считавшие, что вряд ли все эти цифры отражают действительность, так как это материалы специализированных клиник. Например, среди наших стационарных больных саркома Юинга выявлена у 34 человек, что составило 0,026 % (они попадали к нам, как правило, случайно, без установленного диагноза). Как указывают все авторы, располагающие большим материалом, чаще поражаются лица мужского пола.
По данным В.А.Бизера и В.Н.Тимухиной (1987), саркома Юинга редко наблюдается у больных до 5 лет, в последующие 5 лет число больных возрастает в 6 раз и уменьшается к 16 годам. Поражение костей таза, по их данным, отмечается в 20 % случаев. По данным Н.Н.Трапезникова, Л.А.Ереминой и др. (1985), из 230 больных у 69 была поражена бедренная кость, у 25 — кости голени, у 48 — кости верхней конечности, у 48 — кости таза, у 10 — лопатка, у 26 — ребра, у 4 — кости стопы и у 1 больного — верхняя челюсть. Авторы подчеркивают, что саркома Юинга чаще поражает метадиафизарные отделы длинных трубчатых костей, а не диафизов, которые были поражены только в 37 % больных. Наблюдаемые нами 34 пациента распределялись по возрасту следующим образом: 16—20 лет — 20 больных, 21—30 лет — 9, 31—40 лет — 4 и 41—50 лет — 1. Кости таза были поражены у 10, бедренная — у 9, кости голени — у 4, позвонки поясничного отдела у 3, первое ребро — у 1 и кости кисти — у 1 больного.
Клиническая картина у больных с саркомой Юинга протекает неоднотипно и заставляет врачей проводить дифференциальную диагностику не только с остеогенной саркомой, ретикулосаркомой, но и с остеомиелитом и другими даже общими заболеваниями, поскольку, кроме боли и припухлости, наблюдаются общее недомогание и температурная реакция.
В.А.Бизер и В.Н.Тимухина (1987) подразделяют клиническое течение болезни на три варианта. Первый, наиболее частый (58 %) — постоянное постепенное прогрессирование боли, припухлости, температуры. Второй — волнообразное течение то с усилением болей, то снижением, и такой же температурной реакцией. Третий вариант — с безболезненным течением, когда первым симптомом бывает появление опухоли. Рентгенологическая картина: мелкоочаговая деструкция кости, слоистый периостит (луковичный), однако очаги деструкции могут быть и крупными, иногда встречается симптом «козырька». При поражении плоских костей, костей таза рентгенологическая картина может быть сложной, разнообразной: очаги деструкции, вздутие кости, внекостный компонент опухоли. В.А.Бизер и В.Н.Тимухина считают, что разнообразие рентгенологической картины определяется темпами роста опухоли от медленного до бурного.
В последние годы правильно поставить диагноз помогает компьютерная томография.
Для установления диагноза необходимо цитологическое или морфологическое исследование. Дифференциальный диагноз приходится проводить между саркомой Юинга и первичной ретикулосаркомой кости, остеогенной саркомой и остеомиелитом.
Лечение. Длительное время наиболее распространенным являлось лучевое лечение, при этом считалось необходимым производить облучение всей пораженной кости от одного эпифиза до другого даже при локальной форме поражения. Обычная доза колебалась от 50 до 70 Гр, но иногда больные получали и значительно большие дозы.
В.Н.Тимухина (1985) приводит печальные данные о грозных осложнениях, наступающих у больных после лучевой терапии: фиброз мягких тканей, паралич малоберцового нерва, нарушение функции конечности, контрактура в коленном суставе под углом 110—120°, патологический перелом, произошедший у 10 из 15 больных, что заставило произвести ампутацию.
По данным И.И.Соколовой и соавт. (1983), у больных с саркомой Юинга имеется известная взаимозависимость между тяжестью клинического течения и изменениями гематологических показателей. Неблагоприятному течению предшествуют нейтрофильный лейкоцитоз с моноцитозом, уменьшение числа клеток красного ростка костного мозга. Хороший прогноз — ремиссия более 3 лет, продолжительность жизни 5—12 лет — совпадает с эозинопенией, отсутствием макрофагальной реакции в крови при сохранении красного ростка костного мозга.
Ю.А.Пуанов (1988) сообщал, что 5-летняя выживаемость больных с центральной и проксимальной локализацией опухоли составила соответственно 15,2 и 15,4 %, тогда как при дистальной она была равна 58,3 %. По его наблюдениям, при облучении всей пораженной кости у 43 детей местные рецидивы наблюдались у 8 пациентов (18,6 %), а у 34 больных, у которых полной дозой был облучен только патологический очаг, местные рецидивы возникли в 50 % случаев. Ю.А.Пуанов отметил, что 5-летняя выживаемость была равна 54,3%, а при гиперфибриногенемии — 16,8 %. Многие онкологи считают, что саркома Юинга, как и остеогенная саркома, возможно, — системное заболевание, а исследования P.Pearlman (1973) позволили ему считать саркому Юинга быстрорастущей опухолью, при которой метастазы уже имеются к моменту установления диагноза. Предположить, что саркома Юинга является системным заболеванием, позволяют обнаруженные и описанные R.C.Pokko и соавт. (1979) внекостные опухоли, имеющие идентичное с саркомой Юинга строение.
Н.Н.Трапезников, Л.А.Еремина и др. (1987) сообщают, что в ВОНЦ наблюдалось 200 больных с саркомой Юинга, у 144 из них имелась локализованная форма. При лучевом лечении и очаговой дозе 50—60 Гр оказалось, что эта доза достаточна для достижения местного контроля в 77,8 % наблюдений, но у значительной части больных через 11,5 мес наблюдалась диссеминация опухоли, в связи с чем авторы предполагают существование субклинических метастазов еще при первых симптомах заболевания, поэтому имеется абсолютное показание к проведению химиотерапии и лучевого лечения.
Первое сообщение в нашей стране, сделанное Н.Н.Трапезниковым (1964), о необходимости наряду с лечением первичного очага в кости проводить системную химиотерапию для подавления отдаленных метастазов (легкие, кости, в том числе трудно диагностируемые в позвоночник и череп), было одобрено всеми. С тех пор применялись различные вещества в различных комбинациях [Samuels M., Howe С., 1967; Jaffe N.L. et al., 1976; Rosen G. et al., 1977, 1981]. Н.Н.Трапезников, Л.А.Еремина и соавт. (1985, 1987) сообщили, что они получили благоприятные ближайшие результаты при следующем лечении. После окончания лучевой терапии начинают химиотерапию: адриамицин внутривенно по 20 мг/м2 в 1-й, 8-й и 15-й дни, циклофосфан внутримышечно 6 раз в 2 нед — до 1,5 г/м2 на цикл, винкристин внутривенно по 0,75 мг/м2 в 1-й, 8-й, 15-й дни лечения. Всего проводят 9 таких циклов с интервалами 1 мес между 2-м и 3-м, 4-м и 5-м, 6-м и 7-м, 8-м и 9-м курсами и перерывом 2 мес между 3-м и 4-м, 5-м и 6-м, 7-м и 9-м курсами. Этот метод лечения был применен у 30 больных; у 25 из них в сроки от 3 до 12 мес признаков заболевания не отмечено.
N.L.Jaffe и соавт. (1976) при комбинации курса лучевой терапии с полихимиотерапией (винкристин + циклофосфан + актиномицин D) наблюдали полную регрессию опухоли, при этом 70 % больных с локализованной стадией опухоли прожили более 3 лет. А.Ф.Бухны и соавт. (1984) сообщают, что они у большинства больных начинали лечение с полихимиотерапии и при ее эффективности (уменьшение мягкотканного компонента опухоли) проводили лучевое лечение. Как показали исследования, проведенные в ВОНЦ с использованием ЭВМ, длительность болезни до начала лечения, проведение физиотерапевтического лечения, молодой возраст прогностически неблагоприятны. Несмотря на улучшение результатов лечения, все же у большинства больных через разные сроки возникают генерализация процесса и наиболее часто метастазирование в легкие. Л.А.Еремина (1968, 1976, 1986, 1987), В.А.Бизер, А.Ф.Бухны (1984) установили, что у большого числа больных метастазы исчезали под влиянием лучевой терапии и полихимиотерапии, но через несколько месяцев возникали вновь и приводили больных к гибели.
Так же сдержанно относились Н.Н.Трапезников, Л.А.Еремина и соавт. (1985) к операциям, считая, что если оперировать, то пораженную кость нужно удалять целиком. Однако ряд авторов с успехом применили у отдельных больных в комплексном лечении и оперативное вмешательство, в том числе и сохранные операции, при рано диагностированной опухоли без выхода ее за пределы кости и хорошем эффекте предоперационной лучевой терапии. Ампутации показаны при патологических переломах, невозможности произвести сохранную операцию. Некоторые онкологи ставили показания к оперативному лечению 20 % больным. По мнению Л.А.Ереминой (1969), оперативное вмешательство показано в тех случаях, когда опухоль оказывается нечувствительной к лучевой и химиотерапии.
Н.Ю.Полонская (1987), изучавшая особенности химиолучевого патоморфоза опухоли Юинга у 25 больных и ретикулосаркомы у 14 больных, при морфологическом исследовании обнаружила, что опухоль Юинга и ретикулосаркома не всегда чувствительны к химиолучевой терапии: у отдельных больных она наблюдала продолжение роста и рецидивы.
По данным М.М.Нивинской, Л.А.Ереминой и др. (1984), В.А.Бизера (1985, 1987), высокой радиочувствительностью обладают и метастазы в легкие. Необходимо продолжать разрабатывать методику комбинации с химиотерапией, так как у большинства больных метастазы в легких возникают вновь и больные погибают.
Ю.А.Пуанов (Ленинградский онкологический институт им. Н.Н.Петрова) сообщил в 1988 г., что применение только лучевой терапии позволило достичь 5-летней выживаемости лишь у 5,9 % больных, химиолучевой — у 25,0 %, а в группе, где дополнительно оперативно удалялся первичный очаг путем резекции кости, 5-летняя выживаемость составила 84,0 %. Было оперировано 13 больных, которым проводили или экстирпацию кости, или широкие резекции (лопатка, малоберцовая, большеберцовая кости, ребро); у 1 больного выполнена ампутация. Следует согласиться, что оперативное лечение надо включать в комплексную терапию, поскольку ни лучевая, ни химиотерапия не могут привести к гибели все опухолевые клетки.
По данным Н.Н.Трапезникова, Л.А.Ереминой, П.А.Синюкова и Е.М.Слонимской (1986), в ВОНЦ АМН СССР с 1955 по 1984 г. находилось на лечении 230 больных с саркомой Юинга. При лучевом лечении 5-летняя выживаемость составила 7,56±4,86 %, тогда как при адъювантной химиотерапии (циклофосфан, адриамицин, полихимиотерапия) — 31,06±6,04 %. Возможно, следует пересмотреть принятый двухлетний срок, в течение которого проводится химиотерапия, и удлинить его; надо искать критерии, которые могли бы указать на диссеминацию опухоли (сцинтиграфия, показатели крови и т.д.), и этим больным проводить курсы химиотерапии в течение 3-го, 4-го года или в более поздние сроки, поскольку если у больного появляется даже легкое недомогание, субфебрилитет, бывает невозможно выявить мельчайшие «субклинические» метастазы.
Наш опыт говорит о необходимости тщательного наблюдения за больными после окончания курсов полиохимиотерапии, проводимых в течение 2 лет. Под нашим наблюдением находились больные, у которых на фоне полного благополучия через 5—6 лет после начала комбинированного лечения происходит диссеминация процесса. При этом любое, даже легкое недомогание, повышение температуры (субфебрилитет) являются показанием к обследованию больного и даже проведению 2—3 курсов полиохимиотерапии, поскольку через 2—3 или 5 мес состояние больного может стать тяжелым и обнаружиться множественные и больших размеров метастазы.
У некоторых наших больных после 2—3 курсов лучевого лечения наступали некрозы костей и патологические переломы, которые почти никогда не срастались, даже при применении компрессионно-дистракционного метода по Г.А.Илизарову. В случае инфицирования зоны такого перелома — воспаления мягких тканей вокруг спиц — купировать воспаление необычайно трудно и приходится ампутировать конечность. Нами с успехом производились операции фиксации некротизировавшихся длинных трубчатых костей толстыми интрамедуллярными гвоздями, вводимыми «закрытым методом» через коленный сустав, поскольку облученные мягкие ткани некротизировались, если бы доступ был осуществлен через них. И, наконец, всем хорошо известно, что при «плохо» проведенном лучевом лечении иногда наступает такой фиброз облученных тканей, что конечность становится полностью афункциональной.
Необходимо упомянуть и о более редких, но также типичных ситуациях, в которые попадают врачи. Нам пришлось оперировать 2 больных с деструктивным опухолевым поражением тел III и IV поясничных позвонков. Клинико-рентгенологическое обследование и пункционная биопсия не дали результата. Приводим одно наблюдение.
Больной 17 лет с разрушением передних отделов тела III поясничного позвонка, больше справа. Операционный подход осуществлен спереди справа внебрюшинным разрезом. Обнаружено, что в опухоль впаяна поясничная мышца; она пересечена выше и ниже опухоли, а затем широким желобоватым долотом опухоль вместе с припаянной к ней мышцей удалена единым блоком — приблизительно до '/3 тела, дополнительно удален еще слой нормальной на глаз спонгиозы. Послеоперационное течение гладкое.
Микроскопия — опухоль Юинга. Через 2 нед проведен курс лечения сарколизином и циклофосфаном. Через 1,5 мес начат курс лучевой терапии (45 Гр), затем в течение 2 лет проведено еще 5 курсов химиотерапии. Больной закончил школу, затем поступил в институт, был практически здоров 6,5 лет, когда появилось недомогание, а через 4 мес на рентгенограммах в легких было множество крупных метастазов. Рекомендована химиотерапия. Больной умер через 3 мес.
Подобные наблюдения не единичны. Во-первых, у больных, которые после операции становились нетранспортабельными, мы начинали лечение с курса химиотерапии и получали хороший эффект; во-вторых, необходимо строгое диспансерное наблюдение за больными, ставшими практически здоровыми после химиолучевого лечения в течение 6—10 лет и более, чтобы вовремя уловить момент рецидива опухолевого процесса (СОЭ, температурная реакция, общеклинические симптомы и т.д.); в-третьих, мы считаем, что у некоторых больных на каком-то этапе лечения, чаще, чем это делается в настоящее время после курса лучевой терапии и нескольких курсов химиотерапии, по показаниям следует хирургическим путем удалять первичный костный опухолевый очаг, поскольку не всегда первые два метода приводят к гибели всех (100 %) опухолевых клеток.
Проблема дифференциальной диагностики саркомы Юинга с другими круглоклеточными опухолями иногда решается с помощью моноклональных антител. Заслуживает внимания NSE, положительное при всех нейробластомах и отрицательное при других крутлоклеточных саркомах, при саркоме Юинга и лимфоме кости.
Дальнейшие исследования поставили вопрос: либо все саркомы Юинга представляют собой менее дифференцированную форму нейродермальных опухолей кости (PNET), либо этот диагноз должен ограничиваться только атипичной саркомой Юинга. Многие авторы сходятся во мнении, что поставить правильный диагноз саркомы Юинга сложно, нужно прибегать к гистохимическим, иммунохимическим и электронно-микроскопическим исследованиям, чтобы исключить опухоль неврального происхождения.
С.Т.Зацепин
Костная патология взрослых
По данным ВОЗ, сосудистые опухоли подразделены на 3 группы:
1) доброкачественные; 2) неопределенные, или промежуточные; 3) злокачественные.
| Доброкачественные | Неопределенные (промежуточные) |
Злокачественные |
| Ангиомы Капиллярные венозно-капиллярные венозно-кавернозные артериокапиллярные очень редко гломангиомы |
Гемангиомы Гемангиоэндотелиомы |
Ангиосаркомы Гемангиоперицитомы |
Доброкачественные опухоли — гемангиомы — чаще всего встречаются в позвонках, иногда в двух, трех, четырех. Длительное время они могут ничем себя не проявлять, затем появляются боли, которые с трудом поддаются лечению. Диагноз ставят на основании рентгенологической картины, особенно при использовании КТ. Длительный опыт показал, что применяемое лучевое лечение малоэффективно. Гемангиомы могут быть венозные, артериовенозные и артериальные или преимущественно артериовенозные. Возможны попытки лечения путем эмболизации сосудов опухоли гемангиомы позвоночника, но это можно попытаться делать, лишь имея большой опыт работы в специализированных отделениях.
Попытка произвести частичную резекцию тела позвонка и фиксацию может вызвать профузное кровотечение, которое очень трудно остановить.
На всю жизнь запомнился больной 27 лет с резкими болями в нижнегрудном отделе позвоночника и рентгенологической картиной, указывавшей на резкие изменения в телах VIII, IX, X грудных позвонков. Во время операции после резекции ребер с двух сторон мы (оперировал проф. А.И.Казьмин) увидели пульсирующее округлое образование, диаметр которого оказался гораздо больше диаметра позвоночника на этом уровне. Было выполнено единственное, что возможно: вдоль пульсирующей ангиомы позвоночника уложено и фиксировано к ребрам 4 широких, длинных, гладких консервированных аллотрансплантата, наложены швы на мышцы, кожу. Через 6 мес, когда сняли гипсовый корсет, больной отметил уменьшение болей, увеличение устойчивости, через 1,5 года мог свободно проходить 10— 15 км, не испытывая боли, охотясь за зайцами.
Клинически очень демонстративен пример с больным К., 18 лет, поступившим с большой опухолью средней трети правой бедренной кости и сросшимся переломом в этой области (рис. 30.1). Больной от операции решил воздержаться. Приехал через 2,5 мес, когда опухоль резко увеличилась. Произведена экзартикуляция бедра. Микроскопический диагноз: гемангиоэндотелиома. Через 4 мес наступил патологический перелом тела I поясничного позвонка — метастаз опухоли. Нужно помнить, что даже после сегментарной резекции возможны рецидивы через 17 лет и более. Всего мы наблюдали 14 больных с гемангиоэндотелиомой.
Гемангиоперицитома встречается реже; под нашим наблюдением находилось 4 больных: двое с поражением верхнего конца бедренной кости; у одной больной в возрасте 21 года внезапно наступил патологический перелом, и ее доставили из окнологического учреждения, поскольку она отказалась от экзартикуляции в тазобедренном суставе У четвертого больного с поражением лопатки произведены экстирпация лопатки и замещение эндопротезом; отмечено практически полное восстановление функции руки.
Двум первым больным были произведены обширные резекции верхнего конца бедренной кости, при операциях наблюдалась повышенная кровоточивость окружающих нормальных на вид мышечных тканей. Осуществлено эндопротезирование; в течение 2 лет больные получили по 6 курсов лечения циклофосфаном. Здоровы, при ходьбе прихрамывают, на улице ходят с палочкой — отдаленный результат 27 лет.
Вывод, который мы можем сделать на основании собственного опыта лечения больных с гемангиоэндотелиомами и гемангиоперицитомами:
1) опухоли необходимо удалять абластично, оставляя на опухоли слой здоровых тканей;
2) возможно производить сохранные операции с применением эндопро-! тезов.
Однако прогнозировать результат лечения очень трудно или невозможно.

Рис. 30.1. Злокачественная сосудистая опухоль бедренной кости. а — ткань костной мозоли благодаря отсутствию «памяти формы» растягивается, но не ломается; б — рентгенограммы.
Ангиосаркомы
Наблюдали 12 больных, 7 из которых умерли в разные сроки после операции; у 2 пациентов при сохранных операциях наблюдались рецидивы, по поводу которых они были повторно оперированы. Судьба больных после операций неизвестна.
Развитие опухолевого процесса, очевидно, бывает очень стремительным. Так, у больного 55 лет была обнаружена опухоль правой половины таза, которая, судя по анамнезу, быстро росла. При обследовании грудной клетки — легкие прозрачные, без очаговых изменений. Произведена межподвздошно-брюшная ампутация. При обследовании через 3 нед в легких выявлено много довольно крупных метастазов.
Сосудистые опухоли — это опухоли, локализующиеся в костях; опухолевой трансформации со стороны костной ткани не наблюдается. Сравнительно часто встречаются венозно-кавернозные опухоли в верхнем завороте коленного сустава. Если такому больному на бедро наложить слегка натянутый жгут и опустить ногу вниз, едва пальпируемое образование резко увеличится и станет более плотным. При этом можно считать, что диагноз подтвержден.
Однако мы наблюдали ангиосаркому, которая покрывала синовиальную оболочку всего верхнего заворота, имела ярко-красную окраску, что отличало ее от пигментно-виллезно-нодулярного синовита.
Гломусные опухоли
Гломусные опухоли имеют обычно небольшие размеры, сферическую форму в виде узелка и поэтому называются гломусными (glomus — шар). Они могут располагаться во всех тканях человеческого тела, кроме головного мозга. Опухоль состоит из сети анастомозирующих синусоидальных сосудов, снова переходящих в артериальный ствол. Между этими сосудами располагаются рецепторные клетки, являющиеся основой опухоли. Как пишет Е.В.Уранова (1971), гистогенетические гломусы представляют собой дериваты элементов ганглионарной пластинки и закладок парасимпатической системы.
К нехромаффинным параганглиям (гломусам) относят: артериальные, каратидные, югулярные, интравагинальные, пульмональные узелки, узелки по ходу артериальных и венозных стволов конечностей, надкостницы, костного мозга, поперечнополосатой мускулатуры и т.д.
Гломусная опухоль впервые описана в 1876 г. русским врачом Г.Ф.Гобером. Выделяют следующие виды гломусных опухолей:
• обычный тип, характеризующийся альвеолярным и альвеолярно-трабекулярным строением;
• аденомоподобный тип;
• ангиомоподобный тип;
• компактный тип;
• злокачественные варианты.
Наиболее часто встречается опухоль ногтевых фаланг пальцев, чаще под ногтевой пластинкой, через которую просвечивает в виде красноватого или синюшного образования размером 5x7 или 3x12 мм, резко болезненного при надавливании или изменении температуры льющейся на палец струи воды. Ногтевая пластинка над этим образованием часто деформирована, а на рентгенограмме может обнаруживаться дефект ногтевой фаланги. Эти опухоли известны как опухоли Барре—Массона (по именам описавших их авторов) [Barre J., Masson P., 1924].
Лечение только оперативное: под проводниковой анестезией снимают ногтевую пластинку или резецируют часть ее; опухоль, покрытая соединительнотканной оболочкой, легко удаляется. При правильно проведенной операции рецидивы крайне редки.
При разрушении костей черепа, позвоночника и т.п. диагноз, как и оперативное вмешательство, значительно труднее.
Мы наблюдали более двух десятков больных с поражением ногтевых фаланг; в одном случае поражение было симметричным.
Саркома Юинга
Саркома Юинга — очень злокачественная опухоль костей, встречающаяся сравнительно редко. Эта опухоль была выделена Джеймсом Юингом в 1921 г. По мнению Т.П.Виноградовой, раньше она относилась к круглоклеточным саркомам костей. Юинг назвал ее эндотелиомой, а затем многочисленные исследователи относили ее к разным группам опухолей. Этот сложный вопрос до настоящего времени дискутируется. Н.А.Краевский и Б.П.Тарасов включали ее в группу злокачественных гемангиоперицитом.
Б.П.Тарасов практически был согласен с мнением Юинга, подразделяя опухоль на три варианта в зависимости от строения. Подобную же точку зрения высказывала в 1973 г. Т.П.Виноградова, признававшая существование разновидностей саркомы Юинга, исходя из ее микроскопического строения и давшая микроскопическое описание двух из них. Гистогенетический источник опухоли Юинга не установлен, предполагалось ее происхождение из недифференцированных ретикулярных клеток, а также миелогенном, гистиоцитарном, мезенхимальном, ангиогенном происхождении.
Л.В.Литвинова, Ю.Н.Соловьев (1982) в результате электронно-микроскопического исследования пришли к мнению, что опухоль состоит из низкодифференцированных клеток, в которых обнаружены: умеренно развитый ШЭР, аппарат Гольджи, микрофибриллы, лизосомы, пиноцитозные везикулы, псевдоподии, базальные мембраны; клетки формируют единичные тубулярные структуры. Эти данные подтверждают, по мнению авторов, предположение об ангиогенной принадлежности клеток опухоли. Дифференциальный диагноз иногда сложен, его приходится проводить с ретикулосаркомой, метастазами нейробластомы и другими опухолями. В отличие от ретикулосаркомы в саркоме Юинга отсутствуют в определенном порядке расположенные ретикулярные волокна. По данным Ф.Шайовича, в клетках саркомы Юинга имеется гликоген, тогда как в нейробластоме и ретикулосаркоме он отсутствует. У больных с нейробластомой увеличено выделение катехоламинов с мочой.
По D.C.Dahlin (1978), саркома Юинга составляет 6 % в группе злокачественных опухолей костей. F.Schajowicz (1981), наблюдавший 210 больных с саркомой Юинга, говорит о 9,17 %; по данным ВОНЦ, 230 больных, находившихся там на лечении, составляли 25,8 %, однако, очевидно, правы Н.Н.Трапезников, Л.А.Еремина (1985), считавшие, что вряд ли все эти цифры отражают действительность, так как это материалы специализированных клиник. Например, среди наших стационарных больных саркома Юинга выявлена у 34 человек, что составило 0,026 % (они попадали к нам, как правило, случайно, без установленного диагноза). Как указывают все авторы, располагающие большим материалом, чаще поражаются лица мужского пола.
По данным В.А.Бизера и В.Н.Тимухиной (1987), саркома Юинга редко наблюдается у больных до 5 лет, в последующие 5 лет число больных возрастает в 6 раз и уменьшается к 16 годам. Поражение костей таза, по их данным, отмечается в 20 % случаев. По данным Н.Н.Трапезникова, Л.А.Ереминой и др. (1985), из 230 больных у 69 была поражена бедренная кость, у 25 — кости голени, у 48 — кости верхней конечности, у 48 — кости таза, у 10 — лопатка, у 26 — ребра, у 4 — кости стопы и у 1 больного — верхняя челюсть. Авторы подчеркивают, что саркома Юинга чаще поражает метадиафизарные отделы длинных трубчатых костей, а не диафизов, которые были поражены только в 37 % больных. Наблюдаемые нами 34 пациента распределялись по возрасту следующим образом: 16—20 лет — 20 больных, 21—30 лет — 9, 31—40 лет — 4 и 41—50 лет — 1. Кости таза были поражены у 10, бедренная — у 9, кости голени — у 4, позвонки поясничного отдела у 3, первое ребро — у 1 и кости кисти — у 1 больного.
Клиническая картина у больных с саркомой Юинга протекает неоднотипно и заставляет врачей проводить дифференциальную диагностику не только с остеогенной саркомой, ретикулосаркомой, но и с остеомиелитом и другими даже общими заболеваниями, поскольку, кроме боли и припухлости, наблюдаются общее недомогание и температурная реакция.
В.А.Бизер и В.Н.Тимухина (1987) подразделяют клиническое течение болезни на три варианта. Первый, наиболее частый (58 %) — постоянное постепенное прогрессирование боли, припухлости, температуры. Второй — волнообразное течение то с усилением болей, то снижением, и такой же температурной реакцией. Третий вариант — с безболезненным течением, когда первым симптомом бывает появление опухоли. Рентгенологическая картина: мелкоочаговая деструкция кости, слоистый периостит (луковичный), однако очаги деструкции могут быть и крупными, иногда встречается симптом «козырька». При поражении плоских костей, костей таза рентгенологическая картина может быть сложной, разнообразной: очаги деструкции, вздутие кости, внекостный компонент опухоли. В.А.Бизер и В.Н.Тимухина считают, что разнообразие рентгенологической картины определяется темпами роста опухоли от медленного до бурного.
В последние годы правильно поставить диагноз помогает компьютерная томография.
Для установления диагноза необходимо цитологическое или морфологическое исследование. Дифференциальный диагноз приходится проводить между саркомой Юинга и первичной ретикулосаркомой кости, остеогенной саркомой и остеомиелитом.
Лечение. Длительное время наиболее распространенным являлось лучевое лечение, при этом считалось необходимым производить облучение всей пораженной кости от одного эпифиза до другого даже при локальной форме поражения. Обычная доза колебалась от 50 до 70 Гр, но иногда больные получали и значительно большие дозы.
В.Н.Тимухина (1985) приводит печальные данные о грозных осложнениях, наступающих у больных после лучевой терапии: фиброз мягких тканей, паралич малоберцового нерва, нарушение функции конечности, контрактура в коленном суставе под углом 110—120°, патологический перелом, произошедший у 10 из 15 больных, что заставило произвести ампутацию.
По данным И.И.Соколовой и соавт. (1983), у больных с саркомой Юинга имеется известная взаимозависимость между тяжестью клинического течения и изменениями гематологических показателей. Неблагоприятному течению предшествуют нейтрофильный лейкоцитоз с моноцитозом, уменьшение числа клеток красного ростка костного мозга. Хороший прогноз — ремиссия более 3 лет, продолжительность жизни 5—12 лет — совпадает с эозинопенией, отсутствием макрофагальной реакции в крови при сохранении красного ростка костного мозга.
Ю.А.Пуанов (1988) сообщал, что 5-летняя выживаемость больных с центральной и проксимальной локализацией опухоли составила соответственно 15,2 и 15,4 %, тогда как при дистальной она была равна 58,3 %. По его наблюдениям, при облучении всей пораженной кости у 43 детей местные рецидивы наблюдались у 8 пациентов (18,6 %), а у 34 больных, у которых полной дозой был облучен только патологический очаг, местные рецидивы возникли в 50 % случаев. Ю.А.Пуанов отметил, что 5-летняя выживаемость была равна 54,3%, а при гиперфибриногенемии — 16,8 %. Многие онкологи считают, что саркома Юинга, как и остеогенная саркома, возможно, — системное заболевание, а исследования P.Pearlman (1973) позволили ему считать саркому Юинга быстрорастущей опухолью, при которой метастазы уже имеются к моменту установления диагноза. Предположить, что саркома Юинга является системным заболеванием, позволяют обнаруженные и описанные R.C.Pokko и соавт. (1979) внекостные опухоли, имеющие идентичное с саркомой Юинга строение.
Н.Н.Трапезников, Л.А.Еремина и др. (1987) сообщают, что в ВОНЦ наблюдалось 200 больных с саркомой Юинга, у 144 из них имелась локализованная форма. При лучевом лечении и очаговой дозе 50—60 Гр оказалось, что эта доза достаточна для достижения местного контроля в 77,8 % наблюдений, но у значительной части больных через 11,5 мес наблюдалась диссеминация опухоли, в связи с чем авторы предполагают существование субклинических метастазов еще при первых симптомах заболевания, поэтому имеется абсолютное показание к проведению химиотерапии и лучевого лечения.
Первое сообщение в нашей стране, сделанное Н.Н.Трапезниковым (1964), о необходимости наряду с лечением первичного очага в кости проводить системную химиотерапию для подавления отдаленных метастазов (легкие, кости, в том числе трудно диагностируемые в позвоночник и череп), было одобрено всеми. С тех пор применялись различные вещества в различных комбинациях [Samuels M., Howe С., 1967; Jaffe N.L. et al., 1976; Rosen G. et al., 1977, 1981]. Н.Н.Трапезников, Л.А.Еремина и соавт. (1985, 1987) сообщили, что они получили благоприятные ближайшие результаты при следующем лечении. После окончания лучевой терапии начинают химиотерапию: адриамицин внутривенно по 20 мг/м2 в 1-й, 8-й и 15-й дни, циклофосфан внутримышечно 6 раз в 2 нед — до 1,5 г/м2 на цикл, винкристин внутривенно по 0,75 мг/м2 в 1-й, 8-й, 15-й дни лечения. Всего проводят 9 таких циклов с интервалами 1 мес между 2-м и 3-м, 4-м и 5-м, 6-м и 7-м, 8-м и 9-м курсами и перерывом 2 мес между 3-м и 4-м, 5-м и 6-м, 7-м и 9-м курсами. Этот метод лечения был применен у 30 больных; у 25 из них в сроки от 3 до 12 мес признаков заболевания не отмечено.
N.L.Jaffe и соавт. (1976) при комбинации курса лучевой терапии с полихимиотерапией (винкристин + циклофосфан + актиномицин D) наблюдали полную регрессию опухоли, при этом 70 % больных с локализованной стадией опухоли прожили более 3 лет. А.Ф.Бухны и соавт. (1984) сообщают, что они у большинства больных начинали лечение с полихимиотерапии и при ее эффективности (уменьшение мягкотканного компонента опухоли) проводили лучевое лечение. Как показали исследования, проведенные в ВОНЦ с использованием ЭВМ, длительность болезни до начала лечения, проведение физиотерапевтического лечения, молодой возраст прогностически неблагоприятны. Несмотря на улучшение результатов лечения, все же у большинства больных через разные сроки возникают генерализация процесса и наиболее часто метастазирование в легкие. Л.А.Еремина (1968, 1976, 1986, 1987), В.А.Бизер, А.Ф.Бухны (1984) установили, что у большого числа больных метастазы исчезали под влиянием лучевой терапии и полихимиотерапии, но через несколько месяцев возникали вновь и приводили больных к гибели.
Так же сдержанно относились Н.Н.Трапезников, Л.А.Еремина и соавт. (1985) к операциям, считая, что если оперировать, то пораженную кость нужно удалять целиком. Однако ряд авторов с успехом применили у отдельных больных в комплексном лечении и оперативное вмешательство, в том числе и сохранные операции, при рано диагностированной опухоли без выхода ее за пределы кости и хорошем эффекте предоперационной лучевой терапии. Ампутации показаны при патологических переломах, невозможности произвести сохранную операцию. Некоторые онкологи ставили показания к оперативному лечению 20 % больным. По мнению Л.А.Ереминой (1969), оперативное вмешательство показано в тех случаях, когда опухоль оказывается нечувствительной к лучевой и химиотерапии.
Н.Ю.Полонская (1987), изучавшая особенности химиолучевого патоморфоза опухоли Юинга у 25 больных и ретикулосаркомы у 14 больных, при морфологическом исследовании обнаружила, что опухоль Юинга и ретикулосаркома не всегда чувствительны к химиолучевой терапии: у отдельных больных она наблюдала продолжение роста и рецидивы.
По данным М.М.Нивинской, Л.А.Ереминой и др. (1984), В.А.Бизера (1985, 1987), высокой радиочувствительностью обладают и метастазы в легкие. Необходимо продолжать разрабатывать методику комбинации с химиотерапией, так как у большинства больных метастазы в легких возникают вновь и больные погибают.
Ю.А.Пуанов (Ленинградский онкологический институт им. Н.Н.Петрова) сообщил в 1988 г., что применение только лучевой терапии позволило достичь 5-летней выживаемости лишь у 5,9 % больных, химиолучевой — у 25,0 %, а в группе, где дополнительно оперативно удалялся первичный очаг путем резекции кости, 5-летняя выживаемость составила 84,0 %. Было оперировано 13 больных, которым проводили или экстирпацию кости, или широкие резекции (лопатка, малоберцовая, большеберцовая кости, ребро); у 1 больного выполнена ампутация. Следует согласиться, что оперативное лечение надо включать в комплексную терапию, поскольку ни лучевая, ни химиотерапия не могут привести к гибели все опухолевые клетки.
По данным Н.Н.Трапезникова, Л.А.Ереминой, П.А.Синюкова и Е.М.Слонимской (1986), в ВОНЦ АМН СССР с 1955 по 1984 г. находилось на лечении 230 больных с саркомой Юинга. При лучевом лечении 5-летняя выживаемость составила 7,56±4,86 %, тогда как при адъювантной химиотерапии (циклофосфан, адриамицин, полихимиотерапия) — 31,06±6,04 %. Возможно, следует пересмотреть принятый двухлетний срок, в течение которого проводится химиотерапия, и удлинить его; надо искать критерии, которые могли бы указать на диссеминацию опухоли (сцинтиграфия, показатели крови и т.д.), и этим больным проводить курсы химиотерапии в течение 3-го, 4-го года или в более поздние сроки, поскольку если у больного появляется даже легкое недомогание, субфебрилитет, бывает невозможно выявить мельчайшие «субклинические» метастазы.
Наш опыт говорит о необходимости тщательного наблюдения за больными после окончания курсов полиохимиотерапии, проводимых в течение 2 лет. Под нашим наблюдением находились больные, у которых на фоне полного благополучия через 5—6 лет после начала комбинированного лечения происходит диссеминация процесса. При этом любое, даже легкое недомогание, повышение температуры (субфебрилитет) являются показанием к обследованию больного и даже проведению 2—3 курсов полиохимиотерапии, поскольку через 2—3 или 5 мес состояние больного может стать тяжелым и обнаружиться множественные и больших размеров метастазы.
У некоторых наших больных после 2—3 курсов лучевого лечения наступали некрозы костей и патологические переломы, которые почти никогда не срастались, даже при применении компрессионно-дистракционного метода по Г.А.Илизарову. В случае инфицирования зоны такого перелома — воспаления мягких тканей вокруг спиц — купировать воспаление необычайно трудно и приходится ампутировать конечность. Нами с успехом производились операции фиксации некротизировавшихся длинных трубчатых костей толстыми интрамедуллярными гвоздями, вводимыми «закрытым методом» через коленный сустав, поскольку облученные мягкие ткани некротизировались, если бы доступ был осуществлен через них. И, наконец, всем хорошо известно, что при «плохо» проведенном лучевом лечении иногда наступает такой фиброз облученных тканей, что конечность становится полностью афункциональной.
Необходимо упомянуть и о более редких, но также типичных ситуациях, в которые попадают врачи. Нам пришлось оперировать 2 больных с деструктивным опухолевым поражением тел III и IV поясничных позвонков. Клинико-рентгенологическое обследование и пункционная биопсия не дали результата. Приводим одно наблюдение.
Больной 17 лет с разрушением передних отделов тела III поясничного позвонка, больше справа. Операционный подход осуществлен спереди справа внебрюшинным разрезом. Обнаружено, что в опухоль впаяна поясничная мышца; она пересечена выше и ниже опухоли, а затем широким желобоватым долотом опухоль вместе с припаянной к ней мышцей удалена единым блоком — приблизительно до '/3 тела, дополнительно удален еще слой нормальной на глаз спонгиозы. Послеоперационное течение гладкое.
Микроскопия — опухоль Юинга. Через 2 нед проведен курс лечения сарколизином и циклофосфаном. Через 1,5 мес начат курс лучевой терапии (45 Гр), затем в течение 2 лет проведено еще 5 курсов химиотерапии. Больной закончил школу, затем поступил в институт, был практически здоров 6,5 лет, когда появилось недомогание, а через 4 мес на рентгенограммах в легких было множество крупных метастазов. Рекомендована химиотерапия. Больной умер через 3 мес.
Подобные наблюдения не единичны. Во-первых, у больных, которые после операции становились нетранспортабельными, мы начинали лечение с курса химиотерапии и получали хороший эффект; во-вторых, необходимо строгое диспансерное наблюдение за больными, ставшими практически здоровыми после химиолучевого лечения в течение 6—10 лет и более, чтобы вовремя уловить момент рецидива опухолевого процесса (СОЭ, температурная реакция, общеклинические симптомы и т.д.); в-третьих, мы считаем, что у некоторых больных на каком-то этапе лечения, чаще, чем это делается в настоящее время после курса лучевой терапии и нескольких курсов химиотерапии, по показаниям следует хирургическим путем удалять первичный костный опухолевый очаг, поскольку не всегда первые два метода приводят к гибели всех (100 %) опухолевых клеток.
Проблема дифференциальной диагностики саркомы Юинга с другими круглоклеточными опухолями иногда решается с помощью моноклональных антител. Заслуживает внимания NSE, положительное при всех нейробластомах и отрицательное при других крутлоклеточных саркомах, при саркоме Юинга и лимфоме кости.
Дальнейшие исследования поставили вопрос: либо все саркомы Юинга представляют собой менее дифференцированную форму нейродермальных опухолей кости (PNET), либо этот диагноз должен ограничиваться только атипичной саркомой Юинга. Многие авторы сходятся во мнении, что поставить правильный диагноз саркомы Юинга сложно, нужно прибегать к гистохимическим, иммунохимическим и электронно-микроскопическим исследованиям, чтобы исключить опухоль неврального происхождения.
С.Т.Зацепин
Костная патология взрослых
Комментировать:
Похожие статьи:
Удаление гигантских доброкачественных и некоторых злокачественных опухолей крестца
Категории: Костная патология, Лечение при опухолях костей,
Доброкачественные опухоли крестца, особенно неврогенного происхождения — неврилеммомы, нейрофибромы, достигают иногда очень больших, даже гигантских размеров. Они смещают кверху и деформируют мочевой..
Удаление опухолей крестца
Категории: Костная патология, Лечение при опухолях костей,
Рис. 43.14. Тератома крестца. а разрушены III, IV, V крестцовые позвонки — тератома удалена. Метастазы рака в крестце выявлены у 72 пациентов (или 8 %) из 908 оперированных с метастатическими..
Паразитарные и грибковые заболевания костей
Категории: Костная патология, Дисплазии и опухоли костей,
Альвеококкоз и эхинококкоз Частота поражения костей эхинококковом и альвеококкозом на большом материале не исследована и в доступной нам литературе не представлена. К сожалению, то же произошло и с..
Нейрогенные опухоли костей
Категории: Костная патология, Дисплазии и опухоли костей,
Нейрогенные опухоли костей — неврилеммомы и нейрофибромы, как доброкачественные, так и особенно злокачественные, редко встречаются у больных, и даже в специализированных учреждениях и отделениях костной..

