Учебные материалы
Конектбиофарм
Работа
Компании
Реклама от Google
Скорость электрохимических взаимодействий металлов в биологических жидкостях
Естественно, следует помнить, что скорость вероятной коррозии и процессов обмена электронами нельзя прогнозировать только на основании теоретических данных. Всегда необходимо экспериментальное определение скорости электрохимических взаимодействий (коррозия + обмен электронами) в специфической среде in vitro, имитирующей состав телесных жидкостей, или проведение исследований в системе in vivo.
С практической точки зрения, очень важно учитывать, что эксперименты с образцами предварительно пассивированного металла могут не имитировать ситуаций, которые происходят при механическом нарушении пассивного слоя из-за коррозии. Следовательно, требуется подвергать тестируемый материал статическим, динамическим и циклическим нагрузкам.
Коррозия металла
Считается, что разъедающая коррозия представляет собой тип коррозии, наблюдаемой у имплантируемого металла (Вильямс, Роуф, 1978; Мюллер и др., 1996). Продукты, выделяемые в течение этого процесса, оказывают весьма значительное воздействие на уровень биосовместимость материала.
При знакопеременных нагрузках, вызывающих подвижность между поверхностями металлических компонентов имплантатов, например шурупа и спицы, происходит нарушение пассивного слоя и появление многочисленных микротрещин. Это приводит к увеличению площади поверхности имплантата, подвергающейся нагрузке и площади контакта с агрессивной средой организма. В результате этого процесса скорость коррозии поверхности металла может возрастать на несколько порядков и привести к быстрому развитию коррозионной усталости имплантата. Ее можно снизить за счет стабильной фиксации пластин или стержней, достигаемой путем обеспечения прочного контакта между имплантатом, костью и ее фрагментами. Это предупреждает вторичное смещение, возникающее в результате биологической резорбции костной ткани. Следовательно, уменьшение коррозии будет способствовать более высокой стабильности имплантата. Если на границе раздела имплантат/ кость образуются участки высоких концентрации напряжений, то в костной ткани наблюдается остеопороз и остеомаляция, с последующим расшатыванием спиц, пластин, стержней (Мюллер и др., 1996; Kovacs, Davidson, 1993; Moroni et al., 1994).
Элементы, способные к самопассивации, более устойчивы к действию коррозии, т.к. на их поверхности одновременно идут процессы деградации и новообразования пассивного слоя. Естественно, с позиции биосовместимости всегда предпочтительнее большее образование защитных оксидов, чем их разрушение. Если же в результате коррозии оксиды образуются в малом количестве или полностью отсутствуют, то может наблюдаться растворение металла, например за счет его ионных групп (Kovacs, 1992).
Самые низкие величины коррозии, которые пропорциональны сумме скоростей коррозии и обмена электронами, имеют Zr, Ti, Та, Nb и Cr, а также титановые сплавы, например Ti-6V-4Al, Ti-13Nb-13Zr, в условиях оксидированной поверхности. Фактически, скорость электрохимических взаимодействий (коррозия + обмен электронами) этих материалов значительно ниже скорости обмена электронами на графите, который, как и благородные металлы, не имеет защитного оксидного слоя.
С теоретических позиций использование для легирования титановых сплавов, металлов, обладающих способностью к самопассивации, например Zr, Nb или Та, более целесообразно, чем V и Аl, так как при помещении в агрессивную биологическую среду они способствуют образованию дополнительного оксидного слоя и препятствуют выходу токсичных ионов. Ванадий, хром, никель и ряд других элементов не имеют таких свойств. Следовательно, их использование снижает способность сплавов на основе Ti, Zr, Nb и Та к самопассивации.
Если данные металлы поступают в ткани в виде ионов, то они оказывают токсическое действие на клетки. Кроме того, металлы типа Al, V и Мо имеют сравнительно высокие величины обратного поляризационного сопротивления.
В результате этого они могут выделяться во время процесса репассивации на поверхности в виде чистого металла или солей, если тонкая пассивная пленка, образовавшаяся в природных условиях, удаляется, повреждается в результате разъедающей коррозии или механического воздействия. Следовательно, они являются потенциально опасными, т.к. могут непосредственно мигрировать в окружающие ткани в виде ионов или молекул и вызывать развитие токсических, иммунологических и других неблагоприятных реакций.
Все это необходимо учитывать при использовании и разработке новых материалов, т.к. легирующие добавки могут существенно изменить биосовместимость имплантатов (Kovacs, 1992; Kovacs, Davidson, 1993; Bruneel et al., 1988; Davidson, 1993; Alcantara et al., 1999).
Для того, чтобы препятствовать этому процессу, необходимо применять технологии, позволяющие формировать на поверхности имплантатов «толстую» абразивно-стойкую защитную пленку, которая позволит исключить генерирование реакционной поверхности металла, например, на титане, цирконии, на сплавах Ti-13Nb-13Zr или Zr-2.5Nb.
Однако толщина этой пленки не может превышать определенной величины, после которой она будет утрачивать свои адгезивные и высокие биомеханические свойства. Напротив, вместо положительного результата такой подход даст отрицательный (Mishra, Davidson, 1992; Ciada et al., 1997; Jacobs et al., 1998).
Роль адгезии белков на поверхности металла
Адгезия протеинов наблюдается сразу же после введения металлического имплантата в организм. От того, как протекает это процесс, происходит ли при этом конформация белков, его кинетики, во многом зависит уровень биосовместимости материала.
Считается, что продукты коррозии значительно влияют на прочность адгезии протеинов. Очевидно, это может быть связано с обменом электронами.
Существует корреляция процесса удержания протеинов с обратным поляризационным сопротивлением (ОПС) для таких сплавов, как SS-316L, Ti-6Al-4V, Ti-13Nb-13Zr, Ti-13Nb-13Zr, Zr-2.5Nb и оксидированного Zr-1.5Nb. Опыты показывают, что удержание фибриногена возрастает линейно с увеличением ОПС (Yun et al., 1994). В какой-то мере это можно объяснить растущей перестройкой абсорбированного фибриногена, связанной с переносом электронов (Bolz, Shaldach, 1993).
Биоинертные материалы, которые не вызывают или практически не сопровождаются негативными тканевыми реакциями, как правило, имеют низкое ОПС своей поверхности.
Следовательно, уменьшение величины ОПС для металлов капсульной группы может быть использовано для определения общей биосовместимости. Одним из фактов, косвенно подтверждающих справедливость данного предположения, является наличие обратной зависимости между величиной ОПС и способностью остеобластов к адгезии к тестируемому материалу.
Чем ниже ОПС, тем лучше данные клетки прикрепляются к поверхности металла.
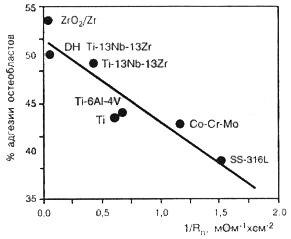
Влияние величины обратного поляризационного сопротивления поверхности металлов на способность прикрепления остеобластов
Этот вывод поддерживается примером оксидированного сплава Zr-2.5Nb, имеющего самое низкое обратное поляризационное сопротивление и показывающего самую высокую степень прикрепления остеобластов (Babu et al., 1995; Kovacs, Davidson, 1996).
Аналогичные данные были получены в нашей лаборатории при исследовании способности костномозговых клеток к адгезии к оксидированному и неоксидированному титану. Установлено, что величина прикрепления клеток к искусственно сформированной методом анодно-искрового оксидирования диоксид-ной поверхности, имеющей высокое переходное сопротивление, в 2,5 раза превышало аналогичные показатели чистого титана.
Другой пример эмпирической корреляции между ОПС и потенциальным индикатором биосовместимости, прикреплением бактерий представлен на рисунке, где видно, что способность Streptococcus sanguis к адгезии зависит от величины ОПС (Babu et al., 1995; Kovacs, Davidson, 1996).
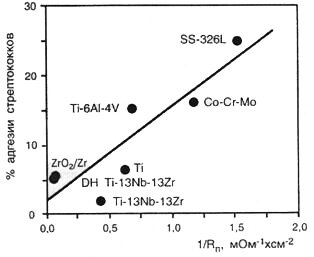
Влияние величины обратного поляризационного сопротивления поверхности на способность бактериальных клеток к адгезии на поверхности металлов
Интересно отметить, что в этом случае более высокая величина ОПС соответствует пониженному бактериальному прикреплению. Это, очевидно, свидетельствует о том, что более сильное электрохимическое взаимодействие между сплавом и средой может затруднить адгезию этих бактерий.
Приведенные данные поднимают очень интересный вопрос о потенциальной роли качества и количества продуктов коррозии для прикрепления определенных бактерий. Теоретически это трудно объяснить.
По-видимому, между строением мембран бактериальной и животной клетки имеется существенное различие, например в распределении молекул адгезии и рецепторов или электростатическом заряде.
Представленные данные требуют проведения дополнительных исследований.
А.В. Карпов, В.П. Шахов
Системы внешней фиксации и регуляторные механизмы оптимальной биомеханики

