Учебные материалы
Объявления
Конектбиофарм
Работа
Компании
Использование для восполнения операционной кровопотери аутогенной крови
Трансфузии, при которых используется собственная кровь больного, излившаяся из кровеносных сосудов, принято считать обратными переливаниями. Использование для восполнения операционной кровопотери собственной крови пациента в значительной мере устраняет риск гемотрансфузионных осложнений, сенсибилизации, предупреждает нарушения гомеостаза (электролитные изменения, коагулопатия, гипертермия), сердечно-легочных проявления и возможность переноса инфекционных болезней, таких как малярия, сифилис, гепатит, СПИД.
Терминология.
Обилие обозначений, используемых при описании обратных переливаний крови, характерно для публикаций с момента возникновения метода и до наших дней. Для обозначения обратного переливания крови использовали термины реинфузия, ретрансфузия, реинъекция, реплантация, аутотрансфузия, аутореинфузия, аутогемотрансфузия и т. д. Часть перечисленных названий употребляли в качестве синонимов, другими обозначали разновидности метода. Отсутствие общепринятой терминологии приводило к неясностям и разночтениям, затрудняло ориентацию в источниках информации и сопоставление данных.
В работах последних лет, посвященных использованию собственной крови больных для возмещения операционной кровопотери, также имеют место смешение понятий и ошибочное использование терминов. Отсутствие общепринятой терминологии в обозначении отдельных разновидностей аутогенных трансфузий препятствует взаимопониманию исследователей, изучающих положительные стороны метода в различных отраслях медицины.
Попытка классифицировать аутогенные трансфузии представляет не только теоретический интерес, так как точное обозначение позволяет полнее использовать возможности каждой из них при составлении программ трансфузиологического обеспечения.
Как и многие исследователи, на начальном этапе работы авторы использовали рабочую классификацию обратных переливаний, по которой выделяли: аутогемотрансфузию - предоперационное консервирование аутокрови, резервирование крови пациента непосредственно перед вмешательством и реинфузию; позднее стали использовать интра- и послеоперационный возврат АЭК как в плановом, так и в срочном порядке, плазмаферез с заготовкой свежезамороженной аутоплазмы. Однако как при анализе данных литературы, так и при сравнительной оценке собственных клинических наблюдений возникали определенные трудности.
Широко распространенное определение «аутологичная кровь» отнюдь не безупречно как в словообразовательном, так и смысловом аспектах. Как принадлежащая человеку, она одновременно гомологична и аллогенна.
Возврат больному после обработки и фракционирования красных клеток теряемой в ходе операции крови не всегда правомочно называть реинфузией, так как конечный продукт, используемый для вливания, в частности при ортопедических операциях, представляет собой взвесь аутоэритроцитов в солевом растворе. Даже при вмешательствах на крупных сосудах, аорте и возврате собранной крови без отмывания клеток, она содержит физиологический раствор и гепарин. Использование недавно предложенного термина «аппаратная реинфузия крови» считаем правомерным только для программ с исключением отмывания её клеток. К реинфузии, с оговоркой, могут быть отнесены и обратные переливания крови, полученной путем фильтрования отделяемого дренажей операционной раны в первые 1 - 2 часа после вмешательства. При соблюдении перечисленных условий больному возвращаются как клетки крови, так и часть плазмы.
Еще в 70-е годы XX века обращали особое внимание на тот факт, что жидкость, выделяющаяся по дренажам в послеоперационном периоде, является своеобразной, существенно отличающейся от крови, аутогенной средой, свойства которой определены временем её нахождения вне сосудов больного.
Поэтому, возвращаясь к предложению Н.Н. Еланского, сделанному в первой основанной на клиническом опыте отечественной монографии «Переливание крови» (1926), считаем правильным использовать обозначения «аутогенная кровь», «аутогенное переливание».
«Аутогенное переливание» приходится признать наиболее удачным собирательным термином, который позволяет объединить переливание собственной цельной крови больного как консервированной, так и резервированной (аутогемотрансфузии), реинфузии, использование компонентов этой крови, а также интра- и послеоперационный возврат концентрата и ли взвеси отмытых эритроцитов крови, полученной из операционной раны и дренажей.
Наряду с основным определяющим свойством (применение для переливания собственной крови больного), каждому из вариантов метода свойственны определенные особенности.
Таким образом, следует выделять аутогенные трансфузии цельной крови (предварительно консервированной - аутогемотрансфузии, стабилизированной - резервирование, и реинфузируемой при излиянии в серозные полости и не свернувшейся) и её компонентов: аутоэритроцитного концентрата или взвеси аутоэритромассы и аутоплазмы.
Аутогенные трансфузии по любой из схем могут дополняться по строгим показаниям компонентами донорской крови.
Нормо- и гиперволемическая гемодилюция
Интраоперационная гемодилюция может осуществляться в нескольких вариантах. Доказано, что избыточное введение жидкостей не создает устойчивого состояния разведения крови без изменения соотношения между объемом циркулирующей крови и емкостью сосудистого русла. Это предполагает две возможности её реализации.
Первая заключается в извлечении некоторого объема крови (резервировании) и замещении изъятого объема кристаллоидными и/или коллоидными кровезаменителями. Этот вариант продолжает использоваться под названием «острая нормоволемическая гемодилюция» (ОНГ).
Суть метода заключается в изъятии части крови больного непосредственно перед началом хирургической операции и замещении ее кристаллоидными и коллоидными кровозаменителями до уровня «оптимальной» гемодилюции для поддержания стабильного объема циркулирующей жидкости - нормоволемии (изоволемии). Взятая кровь в последующем переливается больному по мере нарастания кровопотери, обусловленной хирургическим вмешательством или в конце операции. При этом немаловажно, что теряемая больным в процессе операции кровь содержит сниженное количество эритроцитов.
M.N. D'Ambra с соавторами, T.G. Monk с соавторами считали ОНГ стратегией общего сохранения крови при плановых хирургических операциях. Умеренная ОНГ безопасна у пациентов старше 60 лет; её не рекомендуют для пациентов с заболеваниями коронарных артерий, выраженной анемией, почечной патологией, тяжелые поражениями печени, легочной эмфиземой или обструктивными заболеваниями легких. Сохранение доставки кислорода тканям в течение ОНГ зависит от поддержания нормоволемии, исключения декомпенсации и угнетения функционального состояния сердца.
Острая изоволемическая гемодилюция обеспечивает снижение клеточных потерь после их временного изъятия из системы циркуляции и способствует профилактике тромбоэмболических осложнений после операции. ОНГ обеспечивает возможность переливания свежей цельной крови в день операции и исключает потери крови, связанные со сбором и хранением предварительно консервированной крови. Этот метод исключает возможность административной ошибки, которая может привести к переливанию АВО-несовместимой крови и смерти, так как заготовка крови и реинфузия производятся прямо в операционной. Выполнение ОНГ хирургическим персоналом сводят до минимума расходы на её осуществление.
Собственная кровь больного, содержащая полный набор факторов свертывания и активные тромбоциты, может быть реифузирована после операции или во время нее по клиническим показаниям. Хранение тромбоцитов при комнатной температуре является оптимальным для сохранения их функции.
Аутоэритроциты имеют более высокую функциональную активность и жизнеспособность. Микроагрегаты, образующиеся при использовании любых методов консервирования крови, в свежеконсервированной аутокрови не столь выражены и, главное, способны дезагрегироваться в кровотоке, если кровь возвращают пациенту сразу или в течение первых 6 ч после ее взятия. Все это обеспечивает значительно лучшее, чем при переливании таких же объемов донорской крови, течение послеоперационного периода.
Нормоволемическая гемодилюция проводится или до введения больного в наркоз, или после вводного наркоза, но до начала операции. В последнем случае аутокровь забирается оксигенированной, поскольку искусственная вентиляция легких, проводимая во время наркоза в режиме умеренной гипервентиляции, способствует повышению содержания кислорода в венозной крови. Во время основного наркоза и операции необходим контроль гемодинамических показателей, почасового диуреза, газов крови с целью поддержания нормальной оксигенации тканей и нормоволемии, обеспечивающей адекватную перфузию органов. Гиперволемическая гемодилюция проводится по тем же принципам, что и нормоволемическая, но при этом поддерживается уровень гематокрита в пределах 23-25% с использованием для замещения эксфузируемой аутокрови растворы гидрооксиэтилкрахмала или 5 - 10% альбумина.
Противопоказания для проведения ОНГ:
- нарушение функции легких (рO2 ниже 65 мм рт. ст, артериальное насыщение менее 90%);
- анемия (гематокритное число менее 35%, гемоглобин менее 110 г/л;
- нарушения свертываемости крови (гиперфибринолиз, скорость менее 70%, протромбиновое время больше 55 сек);
- сердечная недостаточность (существенные нарушения сердечного выброса, одышка и стенокардия в покое, признаки ишемии);
- предсуществующая гиповолемия (она должна быть компенсирована до начала ОНГ).
По уровню гематокрита выделяют умеренную (Ht 28%), критическую (Ht 20%) и глубокую (Ht 15%) гемодилюцию.
Расчет допустимого объема изъятия крови проводится индивидуально, учитывая возраст, пол, общее состояние пациента, показатели гомеостаза, Hb, Ht, ожидаемую кровопотерю. Эксфузия крови выполняется при стабильной гемодинамике.
Установлено, что наиболее выраженный эффект достигается при гемодилюции в 21 - 25 %. что соответствует Ht 0,34 - 0,36 л/л. При дальнейшем увеличении степени разведения крови кислородная емкость крови может уменьшаться в большей степени, чем снижается вязкость.
Точная степень разведения крови вряд ли может быть определена однозначно, так как индивидуальные нижние переносимые пределы показателя гематокрита колеблются в широких границах.
Объем эксфузии можно рассчитать по формуле:
V= ОЦК x (Htисх - Htкон )/Htср ,
где ОЦК определяют как 7% массы тела у мужчин, и 6,5% у женщин, Htиcx - уровень гематокрита перед гемодилюцией, Htкон - уровень гематокрита после дилюции, Htср - среднее арифметическое Htисх и Htкон.
Во время проведения ОНГ важно поддержать нормоволемию, так как на фоне гиповолемии сердечный выброс снижается, что может привести к недостаточной оксигенации органов и тканей. Нарушить нормальную реакцию организма на ОНГ может кардиодепрессивный эффект фармпрепаратов (анестетики, особенно галотан; большие дозы фентанила). Прием блокаторов кальциевых каналов и неселективных в-блокаторов не вызывает нарушений нормальных компенсаторных механизмов ОНГ.
В случае применения кристаллоидов приходится вводить тройное количество раствора по сравнению с отобранным объемом крови. Преимущество солевых растворов заключается в быстроте их действия, причем только в случае краткосрочного хирургического вмешательства и при раннем начале ретрансфузии, проблемы с компенсации потери объема не возникают, и практически не обнаруживаются нарушения системы свертывания крови. При длительном хирургическом вмешательстве, когда необходимо дополнительное вливание жидкости, она скапливается в интерстициальном пространстве и образует выраженные отеки, вплоть до создания сложностей закрытия брюшной полости при полостных операциях.
Оптимальные и экономически эффективные результаты при ОНГ обеспечивает применение растворов 6% ГЭК фармакологической группы HES 200/0,5 (в частности Инфукол). При нормоволемической гемодилюции компенсация ОЦК достигается путем введения равного (1:1) его объема. ГЭК 130/0.4 (Волювен) обладает улучшенными фармакокинетическими свойствами.
В отличие от декстранов, препаратов желатины, растворы гидрооксиэтилкрахмала не вызывают аллергических реакций, послеоперационных интерстициальных отеков, обеспечивают стойкое волемическое действие.
Острая изоволемическая гемодилюция ведет к сокращению потребности в трансфузии от 18% до 90%. При тотальном эндопротезировании ТБС только 41% пациентов после ОНГ требовались трансфузии ранее заготовленной аутокрови по сравнению с 75% в группе контроля. Кроме того, понадобилось меньшее её количество (в среднем 41% оцененной потери крови) по сравнению с группой контроля (71%). Чистое время анестезии при осуществлении гемодилюции увеличилось в среднем на 11,4 минут.
Математическое моделирование ОНГ в некардиохирургических условиях показало, что этот метод не эффективен, пока кровопотеря не станет значительной (более 3000 мл), и порог трансфузии составит примерно 25%.
Неожиданная потеря крови в ходе операции может обернуться гиповолемией, падением сердечного выброса и декомпенсацией. Это состояние усугубляется чрезвычайной гемодилюцией. Поскольку острая нормоволемическая гемодилюция наиболее полезна в сложных случаях с вероятностью внезапной неожиданной потери крови, применение её ограничивается центрами с анестезиологами, имеющими опыт в использование ОНГ.
Резервирование аутокрови используется нами как составная часть методики нормоволемической гемодилюции. Стабилизированная (консервированная) аутокровь сохраняется в течение нескольких часов при комнатной температуре, и трансфузия производится на заключительном этапе операции или в ближайшем послеоперационном периоде.
Одним из методов сокращения переливания чужеродной крови является предоперационная гиперволемическая гемодилюция. При предоперационной гиперволемической гемодилюции (ГГ) происходит разведение циркулирующей крови, для того чтобы при кровопотере во время операции терялось меньше эритроцитов на каждый миллилитр крови. В противоположность предоперационной нормоволемической гемодилюции (ОНГ), это происходит только посредством внутривенной инфузии коллоидных и солевых растворов без одновременного забора крови, то есть увеличением внутрисосудистого объема крови.
Предоперационная ГГ проводится непосредственно перед или после введения в наркоз. В зависимости от исходного гематокрита пациента, массы его тела и предполагаемого гематокрита можно перелить до 40 мл/кг гемодилютанта. Могут быть использованы солевые или коллоидные растворы на основе декстрана, желатины или гидроксиэтилкрахмала(НЕЗ). С учетом реологии, фармакокинетики, переносимости лучшим средством для гиперволемической гемодилюции является на сегодняшний момент HES.
Предоперационная гиперволемическая гемодилюция не показана больным с выраженной коронарной недостаточностью, тяжелыми нарушениями ритма сердца, гипертонией (систолическое АД более 180 мм рт.ст.), тяжелыми поражениями легких с респираторной недостаточностью, почек, печени, нарушениями в системе свертывания, при наличии очагов инфекции.
Методика внутрисосудистой ГГ, основанная на сочетанием применении ганглиолитических препаратов (в частности, пентамина) и инфузии кровезаменителей для восстановления соответствия емкости сосудистого русла объему циркулирующей крови и предотвращения избыточной артериальной гипотонии, успешно использовалась в отделе анестезиологии РНИИТО им. P.P. Вредена в 1973 -1978 гг., в том числе и в сочетании с переливанием ранее заготовленной аутокрови. Она находит применение и в повседневной практике сегодняшнего дня.
Предоперационная заготовка и консервирование аутокрови
До настоящего времени одним из эффективных путей достижения максимальной безопасности гемотрансфузионного обеспечения плановых операций остается аутогемотрансфузия (АГТ). Под АГТ мы понимаем переливание собственной консервированной крови пациента, взятой у него как у донора заблаговременно до операции (возможны эксфузии однократные, повторные и повторные с вливанием ранее заготовленной аутокрови).
Наиболее полно преимущества аутотрансфузий перечислены В.А. Аграненко в одноименной главе руководства "Клиническая трансфузиология"; причем отмечено, что преимущества эти соотносятся с недостатками гомологичных трансфузий.
При аутогенной трансфузии исключаются или отсутствуют:
- вероятность осложнений, связанных с трансфузиями несовместимой крови и эритроцитной массы;
- посттрансфузионные негемолитические реакции;
- риск аллоиммунизации;
- возможность заражения реципиента инфекционными, вирусными, паразитарными и другими заболеваниями;
- возможность развития синдромов гомологичной крови и острой легочной недостаточности;
- опасность развития трансфузионнообусловленной болезни «трансплантат против хозяина»;
- вероятность иммунологического конфликта;
- иммунодепрессивный эффект трансфузии.
Кроме того:
- предоставляется возможность использования для трансфузий крови и эритроцитной массы малых сроков хранения;
- теряют остроту проблемы обеспечения хирургических операций донорской кровью вообще и малых сроков хранения в частности;
- сохраняются запасы донорской крови, что дает определенный экономический эффект;
- обеспечиваются кровью и ее компонентами больные редких групп, у которых затруднено перекрестное типирование при подборе совместимой крови, особенно по системе HLA;
- повышается лечебный (антианемический) эффект трансфузии;
- отмечается более быстрое послеоперационное восстановление крови, утраченной во время операции, вследствие стимуляции гемопоэза повторной предоперационной кроводачей и большим заместительным эффектом трансфузии аутокрови;
- явные психологические преимущества для больного (используется «собственная, а не чужая кровь»).
Общие принципы проведения аутогемотрансфузии. Кровь больных для последующего консервирования и переливания заготавливают методом двухэтапной заготовки крови, предложенным и разработанным А.Е. Киселевым и П.К. Покровским. Сущность его заключалась в промышленном выпуске стерильного консервирующего раствора в герметически закрытых стеклянных флаконах на первом этапе и взятии крови от доноров как в стационарных боксированных операционных, так и в приспособленных помещениях на втором этапе. Подобным методом пользовались и за рубежом, различие состояло лишь в составе консервирующих растворов.
На этапе апробации метода большинство хирургов производили предоперационную эксфузию однократно в объеме 150 - 400 мл. Как правило, объем эксфузии для конкретного больного не индивидуализировали, Имелись примеры увеличения объема предоперационной эксфузии до 600 мл и проведения повторных (от двух до четырех) эксфузий с общим объемом заготовленной аутокрови до 2000 мл.
В последние годы при отсутствии противопоказаний объем однократной эксфузии для взрослого донора составляет 400 - 450 мл, что определяется как емкостью пластикового контейнера, так и количеством содержащегося в нем консервирующего раствора (например, «Гемакон» 500/300»).
Промежутки времени между изъятиями крови составляли от четырех до десяти дней. Многими зарубежными авторами заготовка аутокрови выполнялась еженедельно. M.Wittig с соавторами считали допустимым использование более коротких интервалов между донациями. В нашей практике интервалы между эксфузиями составляли 4-5 дней, а промежуток между последней эксфузией и операцией - не менее 3 суток.
По вопросу о необходимости возмещения объема изъятой крови не сложилось единого мнения. П.А. Буклей не производил замещения. В.П. Мусатов инфузировали изотонический раствор хлористого натрия или глюкозы с поливитаминами в количестве 500 - 1000 мл. Г.И. Таруашвили рекомендовал вливание коллоидных кровезаменителей (декстран, полиглюкин).
Сроки от взятия крови до оперативного вмешательства колебались от нескольких часов (при использовании методики «резервирования» собственной крови и проведения гемодилюции) до 7 -10 суток при аутогемотрансфузии.
В случае осуществления повторных эксфузий с целью заготовки большего объема аутологичной крови от первой эксфузии до операции проходило до 21 суток. Иногда переливали ранее заготовленную кровь больного, увеличивая объем последующих эксфузий, что давало возможность получить перед операцией большие объемы (до 2000 мл) свежей двух - четырехдневной аутологичной крови.
Хранение аутологичной крови, кроме случаев ее криоконсервирования, осуществляли в холодильнике при температурах, обеспечивающих её качество, в соответствии с действующими инструкциями службы крови. Для исключения вероятности использования аутокрови в качестве донорской был предложен особый цвет сигнатуры.
Использование для консервирования аутокрови низких (-196° С) температур позволяло накапливать в течение длительного времени большие количества аутологичной крови с сохранением кислородотранспортной функции эритроцитов. Этот вариант метода доступен лишь специально оснащенным учреждениям службы крови.
Эксфузия крови. Эксфузия крови представляет собой частный вид венозного кровотечения, ограниченного по объему и осуществляемого со сравнительно небольшой объемной скоростью. При этом возникают, как и при всякой кровопотере, патологические изменения и приспособительные реакции. Первые заключаются в уменьшении объема циркулирующей крови за счет как глобулярного, так и плазматического объемов. Уменьшение количества эритроцитов и, следовательно, циркулирующего гемоглобина ведет к снижению кислородной емкости крови. Адаптационные механизмы включают повышение тонуса мелких сосудов и мобилизацию депонированной крови. Преобладание симпатических влияний обусловливает тахикардию, что в условиях уменьшенной емкости сосудистого русла приводит к ускорению кровотока и способствует поддержанию уровня артериального давления. Увеличение объема легочной вентиляции обеспечивает лучшие условия оксигенации крови и облегчает венозный возврат крови к сердцу.
К адаптационным механизмам также относят поступление в сосудистое русло внеклеточной жидкости, повышение свертывающего потенциала крови и тканевые приспособительные реакции, выражающиеся в повышении ферментной активности и усилении анаэробного типа дыхания.
Выраженность патологических изменений в значительной мере определяется объемом взятой крови. При объеме эксфузии до 300 мл не отмечали изменения указанных показателей. Увеличение объема эксфузии до 400 - 450 мл вызывало у части больных незначительное снижение артериального давления и учащение сердечных сокращений как непосредственно после взятия крови, так и в первые трое суток. В единичных случаях после взятия крови наблюдали коллаптоидные реакции, которые отмечены и при взятии крови у доноров. Эти осложнения связаны с расширением венозных сплетений брюшной полости вследствие раздражения вагуса.
У ортопедических больных зафиксированы минимальные гемодинамические изменения в ответ на эксфузию: частота пульса до взятия крови - 87, а после эксфузии - 85 уд/мин; максимальное АД снижалось в среднем с 139 до 125 мм рт. ст., минимальное практически не изменялось - с 79 мм рт. ст. до 76 мм рт. ст.
М.В. Агальцов с соавторами при помощи суточного мониторирования регистрировали биоэлектрическую активность миокарда у 20 пациентов до и после сложных хирургических вмешательств на опорно-двигательном аппарате с применением аутогемотрансфузии. В раннем послеоперационном периоде отмечены тахикардия преимущественно в ночные часы, нарушение циркадного ритма сердца, депрессия сегмента ST по ишемическому типу без типичных клинических проявлений. Эти изменения более выражены у больных старшей возрастной группы, что необходимо учитывать при планировании характера оперативного вмешательства и вида гемотрансфузии.
Изменение общего состояния больных, связанное с основным хирургическим заболеванием, не может не отразиться на их реакции на кровопускание.
Изучение гемодинамики показало незначительное уменьшение ударного объема сердца, минутного объема кровообращения с умеренным повышением периферического сопротивления после эксфузии. На третьи сутки после взятия 400 мл крови операции проходили в условиях некомпенсированных нарушений гемодинамики. На 7 - 10 сутки, по данным тех же авторов, все показатели гемодинамики приходили к исходному уровню.
С.А. Матвеев с соавторами установили, что у больных с ишемической болезнью, врожденными и приобретенными пороками сердца однократные эксфузии крови в дозе 400 - 500 мл, плазмы в объеме 600 - 1500 мл не вызывали существенного ухудшения состояния.
Изучение морфологического состава крови у больных с заболеваниями органов брюшной полости, щитовидной железы не выявило выраженных изменений количества эритроцитов и содержания гемоглобина после эксфузии до 250 мл. При изъятии до 400 мл отмечено уменьшение количества эритроцитов на 350 - 800 тыс в мм3, содержания гемоглобина на 0,8 - 1,0 г/%. Цветовой показатель не менялся.
Н.М. Бондаренко и В.Я. Березницкий исследовали картину красной крови и морфофункциональное состояние эритроцитов у больных до и после операций на органах брюшной полости при применении методики поэтапной предоперационной заготовки аутокрови.
Через 4-5 дней после первой эксфузии в объеме 400 - 450 мл аутокрови у больных отмечено снижение эритроцитов на 8,4% при исходной величине 4,52 х 1012 г/л), гемоглобина на 6,85% при исходном значении 138,8 г/л), гематокрита - на 6,1% (исходное значение - 41,67%).
Обычно показатели красной крови (содержание гемоглобина, эритроцитов, гематокрит и др.) восстанавливаются через 14-20 дней после эксфузии 300 - 400 мл. Это положение должно лечь в основу определения дозы эксфузии, сроков ее повторения и дня операции. Снижение гемоглобина в крови более чем на 15% исходного, на любом этапе заготовки аутокрови становится противопоказанием к следующей гемоэксфузии. Анемия должна рассматриваться как временное противопоказание к аутогемотрансфузии. При уровне гемоглобина 110 - 120 г/ л безопасна и допустима эксфузия 250 - 300 мл, так как более высокая доза может вызвать снижение показателей гемоглобина и эритроцитов, которые не восстановятся к моменту операции.
Большинство авторов, изучавших реакцию кроветворного аппарата на взятие крови, отмечали увеличение содержание ретикулоцитов периферической крови и на основании этого делали заключение о стимуляции эритропоэза.
По данным М. Wittig с соавторами, количество ретикулоцитов возрастало с 46 х 103/мкл до 94 х 103/ мкл на 7 день при интервалах между эксфузиями в 3-4 дня, и с 44 х 103/мкл до 108 х 103/мкл на 14 день при еженедельном изъятии крови.
Впрочем, J. Cuello с соавторами не считали увеличение числа ретикулоцитов достаточным доказательством стимулирующего действия эксфузии на эритропоэтическую функцию.
Способность организма к восстановлению утраченного гемоглобина и эритроцитов в значительной мере определяется состоянием запасов железа в организме. Кровопотеря приводит к снижению содержанию железа в плазме. Одноразовое взятие 400 - 500 мл крови равно потере 200 мг железа, что превышает способность абсорбции железа из пищи и приводит к снижению уровня плазменного железа на 10 - 15 мг/%. При истощении депо даже в случае однократной кровопотери уровень железа в плазме остается низким, развивается картина гипохромной анемии. Нарушения обмена железа могут быть вызваны как повторными кровопотерями и нарушением поступления железа в организм, так и неспецифическими заболеваниями. Снижение железа сыворотки наблюдается при остеомиелите, ревматоидном полиартрите, а также при воспалении, инфекции и интоксикации независимо от этиологии. Показатели обмена железа у больных с деформирующим артрозом крупных сосудов, последствиями повреждений костей конечностей не отличаются от таковых у практических здоровых людей и свидетельствуют об отсутствии скрытого дефицита железа.
Операции на опорно-двигательном аппарате вызывают снижение уровня негемоглобинового железа, которое продолжается до седьмого дня послеоперационного периода, затем отмечается его медленный подъем и только на 21-30 день восстанавливается исходный уровень.
Как указывал В.Н. Петров, уровень гемоглобина в крови не может быть использован в качестве диагностического теста, а определение концентрации железа в сыворотке крови недостаточно для выявления скрытого его дефицита. Наиболее точным является комплексное исследование с обязательным определением железосвязывающей способности сыворотки крови и процента насыщения трансферрина.
Показания. Показанием для предоперационной заготовки аутогенной крови служит предполагаемая кровопотеря, превышающая объем, который может быть компенсирован организмом больного. Показания для аутогенного переливания могут быть поставлены шире, чем для переливания компонентов донорской крови.
Показания к АГТ должны устанавливаться индивидуально в соответствии с принятыми общими показаниями к гемотерапии. Однако особенность предоперационной заготовки аутокрови заключается в том, что они должны назначаться и планироваться своевременно и в зависимости от тяжести операции, ее длительности, травматичности и, главное, предполагаемого объема кровопотери, в связи с чем избирается тот или иной вариант заготовки аутокрови и/или ее компонентов и их объем.
О.Н. Рассамахина с соавторами считают, что аутогемотрансфузия показана и достаточна при операциях по поводу коксартроза, опухолей костей, последствий переломов длинных трубчатых костей, таза и кровопотере, не превышающей 15% ОЦК.
Как показывает наш опыт, заготовка аутокрови показана большинству больных перед тотальным эндопротезированием ТБС и ревизионными вмешательствами на нем, а также вертебрологическими операциями.
Планирование аутогенных трансфузий. Убедить трансфузиологическую службу принять программы заготовки аутокрови и сократить число гомологичных трансфузий при плановых операциях могут только экономическая выгодность заготовки аутокрови в стационарах и положительные результаты её использования.
Учреждения службы крови и трансфузиологи обязаны информировать врачей, а также пациентов до получения у них согласия на трансфузионную терапию о вероятных опасностях переливания компонентов донорской крови и возможности альтернативного переливания аутогенной крови.
В. Калнберз и Ю. Жукова считают метод применимым для любой ортопедической клиники и связывают рост использования аутокрови, помимо усовершенствования методов её консервации и хранения, с тем обстоятельством, что переливание аутологичной крови не нарушает гомеостаз (особенно иммунный статус) и снижает риск передачи инфекционных заболеваний. В больнице травматологии и ортопедии г. Риги объем заготовки аутокрови за одиннадцать лет (1980 - 1990 гг.) возрос в 9 раз.
При планировании заготовки крови перед большим ортопедическим вмешательством всегда существует некая раздвоенность цели. С одной стороны, желательно заготовить столько аутокрови, чтобы исключить дополнительную трансфузию компонентов донорской крови. С другой, повторные эксфузии ведут к снижению, часто значительному, содержания гемоглобина, что, как известно, увеличивает вероятность и объем возможной трансфузии, требует дополнительного пребывания больного в стационаре, если они не производятся амбулаторно.
По мнению F. Komatsu, наличие 800 мл аутогенной крови достаточно, по крайней мере, для 80% подобных пациентов; при соблюдении этого условия в ходе 89% ортопедических операций была перелита только аутогенная кровь. Гомологичная трансфузия потребовалась лишь пациентам с кровопотерей свыше 2200 мл.
D.J. Roxby с соавторами использовали программу дооперационной заготовки аутогенной крови по инициативе больного, согласно которой пациентов отбирали из ожидавших плановой операции без формального направления хирурга. При использовании указанного подхода число эксфузий возросло с 8 до 33 в месяц без каких либо осложнений. По мнению авторов, подобная система была практична и рентабельна, способствовала сокращению гемотрансфузионных осложнений.
S.W. Renner с соавторами проанализировали результаты использования предварительно заготовленной аутогенной крови в 612 больницах. Регистрировали число аутодоноров, количество заготовленных, перелитых, не перелитых и забракованных доз аутокрови; пациентов, получивших только аутогенную кровь и потребовавших дополнительно гомологичной крови. Большинство аутодоноров (89,7%) избежало переливания гомологичной крови, включая тех (39,5%), кому переливание не потребовалось. Кровь, заготовленная для операций с малым риском, составила 23,1% всех доз, а частота эксфузий для таких вмешательств была прямо пропорциональна числу случаев, не потребовавших переливания, и частоте брака. Авторы пришли к заключению, что основным направлением улучшения практики аутогенного переливания должно стать сокращение заготовки аутокрови для операций, при которых переливание крови требуется в редких случаях.
Анализ использования криоконсервированных аутогенных эритроцитов показал, что значительная часть доз, заготовленных без четкого планирования, не была перелита.
A.L. Hull с соавторами по результатам анализа параметров трансфузионной терапии у подвергшихся плановым ортопедическим вмешательствам больных предложили принять более низкий уровень гематокрита для аутогенных доноров, не заготавливать избыточных количеств аутокрови, не перевосполнять пациентов их собственной кровью и не допускать остатков аутогенной крови.
Заготовка аутогенной крови вносит значительный вклад в создание запаса крови для плановой операции и предотвращает введение приблизительно 70 - 75 % аллогенной крови пациентам, которые подвергаются большим операциям, включая тотальное эндопротезирование тазобедренного сустава, в плановом порядке.
Общее состояние больных с ортопедическими заболеваниями позволяет производить у них предоперационное взятие крови для целей аутогемотрансфузии. Доказана безопасность дозированного изъятия крови перед плановыми ортопедическими вмешательствами. В многочисленных работах определен рациональный объем эксфузии и подтверждены преимущества переливаний аутологичной крови для замещения операционной кровопотери.
За рубежом хирурги, выполняющие эндопротезирование крупных суставов, усиленно пропагандируют аутодонорство и рекомендуют заготовку аутокрови для больных с тяжелыми сопутствующими заболеваниями. Следует признать, что пациенты с ограниченными резервами дыхательной системы или ишемическими заболеваниями сердечной мышцы - далеко не идеальные кандидаты для проведения эксфузии, но часть из них может быть аутодонорами. Р.Т. Toy с соавторами пришли к заключению, что у пациентов, состояние которых допускает заготовку аутокрови и операции выполняются в плановом порядке, аутогенные переливания используются недостаточно.
Обзор первичных тотальных эндопротезирований тазобедренного сустава с использованием предоперационной заготовки аутогенной крови за 5 лет выявил явный ростаугогемотрансфузий: в 1988 - 1989 гг. - 18% всех операций, в 1990г.-37% и в 1991 -1992гг. - 73%, что отразило возрастающую популярность аутогемотрансфузии и ослабление ограничений по возрасту.
G.V. Miller с соавторами анализировали эффект аутогемотрансфузии при тотальном замещении суставов эндопротезами ретроспективно. Группу из 99 пациентов, получивших аутогемотрансфузию, сравнивали с 55 пациентами контроля. Взятая по одной дозе за 14 и 7 дней до операции цельная кровь была перелита интраоперационно. Дооперационные значения гемоглобина находились в пределах нормальных величин у всех пациентов кроме женщин, для которых средние значения составили 122 + /- 11,3 г/л. Из-за периоперационной гемодилюции, послеоперационные показатели гемоглобина были существенно ниже дооперационных для всех обследованных. В среднем интраоперационная потеря крови была аналогична для аутогенной группы и контроля (от 650 до 750 мл). Не отмечено никаких побочных реакций при аутогенных переливаний, и 74% больных получили только собственную кровь. Предложено осуществлять трехкратную заготовку в течение 3 недель до операции. Такой стандартизированный подход, по мнению авторов, обеспечит простоту выполнения программы для различных операций.
M.G. Sharland с соавторами на примере 529 последовательных операций тотального эндопротезирования ТБС оценили влияние заготовки аутогенной крови на сокращение потребности в гомологичной трансфузии. В 1991 - 1992 гг. только у 4% аутогенных доноров при первичном эндопротезировании ТБС потребовалось переливание аплогенных компонентов крови, по сравнению с 84% у остальных реципиентов. После ревизионных вмешательств в тот же период 36% аутогенный донорам и 100% реципиентов, не имевших аутогенной крови, потребовались аллогенные трансфузии. Частота ревизионных операций составила 33% от общего числа. Потеря крови, объемы переливания и время операции были идентичны. Пред- и послеоперационные концентрации гемоглобина в аутогенной группе были ниже - 15 и 10 г/л соответственно после первичного эндопротезирования ТБС и 10 г/л в обоих группах после ревизионного .
R. Yomtovian объясняет быстрый рост самого безопасного аутогенного переливания с середины 80-х годов, прежде всего реакцией на обнаружение вероятности гемотрансмиссивной передачи вируса СПИДа.
По его мнению, существенное повышение безопасности переливания донорской крови, достигнутое в течение последнего десятилетия, требует переоценки роли аутогенного переливания и, в частности, его способности обеспечить повышенную безопасность при сохранении рентабельности.
Ограничение необоснованных переливаний, осторожный подбор донора, обязательное дополнительное назначение препаратов железа, унифицирование стратегии трансфузии способны предотвращать несчастные случаи и ошибки, что позволит окончательно определить пользу дооперационной заготовки и переливания аутогенной крови.
При подготовке к плановой операции в РНИИТО им. P.P. Вредена всегда учитываются приемы, сокращающие кровопотерю и минимизирующие вероятность применения компонентов донорской крови. Применяется следующая схема планирования трансфузионного обеспечения операций эндопротезирования.
После клинического, рентгенологического и лабораторного обследования больного, подтверждения показаний для оперативного лечения и уточнения характера предстоящего вмешательства лечащим врачом и трансфузиологом решается вопрос о допустимости и объеме заготовки аутогенной крови, назначаются препараты железа и эритропоэтина. Врач-анестезиолог при первичном осмотре больного и планировании анестезиологического пособия с учетом особенностей предстоящей операции, основного и сопутствующих заболеваний принимает решение о возможности использования острой нормоволемической гемодилюции и необходимости периоперационного возврата аутоэритроцитного концентрата. План трансфузиологического обеспечения в доступной форме излагается больному для получения его согласия. Специально оговариваются возможность расширения объема операции, величины операционной кровопотери и возникновение необходимости переливания компонентов донорской крови.
До настоящего времени для восполнения периоперационной кровопотери широко используются переливания заготовленной заблаговременно цельной консервированной крови больного - аутогемотрансфузия. Представление о количестве аутогенных трансфузий, произведенных в РНИИТО им. P.P. Вредена за последние годы дает рисунок 1. За 14 лет 4784 больным заготовлено 7092 дозы аутокрови.
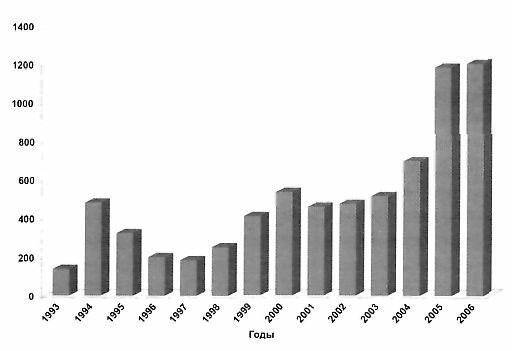
Рис. 1. Количество доз аутогенной крови, заготовленной в клиниках РНИИТО им. P.P. Вредена в 1993 - 2006 гг.
Требования к донору аутокрови.
Лечащий врач больного, хорошо знающий состояние его здоровья и компенсаторные возможности, должен являться главным лицом, осуществляющим отбор доноров аутокрови, назначающим дозировку кроводачи и интервал между ними.
Минимальным уровнем показателей красной крови для кроводачи считаются: Hb - 11 г%; Ht - 0,32 - 0,33 л/л. Безусловно, эти пограничные значения показателей относительны и должны индивидуализироваться в зависимости от состояния больного.
Донор аутокрови подвергается клиническому и лабораторному обследованию в соответствии с требованиями, которые предъявляются к донору гомологичной крови (определение группы крови и резус-фактора, реакции на сифилис, гепатит, ВИЧ и др.). Проведение этих исследований необходимо, так как при взятии и последующей обработке аутокрови не исключается прямой контакт медицинского персонала с кровью больного - возможного носителя вирусных заболеваний. Такой контакт возможен во время заготовки крови, при центрифугировании (не исключается разрыв полимерного контейнера); в процессе криоконсервирования, размораживания, деглицеринизации, отмывания. В связи с перечисленным В.А. Аграненко считает, что потенциальные доноры аутокрови с выявленными отрицательными лабораторными показателями должны быть исключены из числа кандидатов на аутотрансфузию.
Положительное серологическое тестирование аутореципиента на ВИЧ, гепатит и сифилис служит противопоказанием к использованию аутодонорства (Пр. МЗ РФ № 363 от 25 ноября 2002 г).
За рубежом в связи с требованием обследования аутодонора на наличие инфекционных заболеваний возникло множество этических проблем. Допустимость подобного обследования пациентов, дооперационно сдающих их собственную кровь, обсуждена в работе R.E. Domen. Автор считает, что необходимо следовать тактике, которая в равной мере защищает права пациента, учреждений и работников здравоохранения.
Во время изъятия крови необходимы постоянное врачебное наблюдение за больным и контроль показателей гемодинамики.
B.D. Spiess с соавторами на основании исследования гемодинамики 123 больных с повышенным
риском кроводачи считают, что гемодинамические изменения не настолько выражены, чтобы представлять опасность. Авторы указывают на меньший для больных в подобных случаях риск при заготовке аутогенной крови, чем при аллогенной трансфузии.
J. Au Buchou, М. Popovsky на большом клиническом материале, включившим данные 5660 эксфузий, отметили отрицательные реакции лишь у 4,3% доноров аутокрови, главным образом молодых людей в возрасте менее 17 лет и женщин малого веса (< 50 кг). У 99% пациентов с сердечно-сосудистыми заболеваниями реакций не было. Эти наблюдения позволили авторам расширить число возможных аутодоноров.
Противопоказания для предоперационной эксфузии.
К противопоказаниям для заблаговременной, предоперационной заготовки аутокрови от больных относят:
- возраст меньше 8-10 лет и больше 75 лет; выраженные проявления (симптомы) болезни или ее осложнений в день кроводачи;
- выраженную анемию (Hb< 10-11 г%, Ht<0,30 - 0,34л/л);
- сердечно-легочную недостаточность, коронарную болезнь, гипотонию (АД < 100/60 мм рт. ст.), нестабильную стенокардию, недавно перенесенный инфаркт миокарда, желудочковую аритмию, AV-блокаду;
- выраженное истощение, адинамию, слабость;
- бактериемию, сепсис, вирусные заболевания;
- метастазирующий рак; тяжелую бронхиальную астму; выраженные нарушения функции печени, почек;
- гемофилию; эпилепсию;
- большие сроки беременности; наследственные заболевания крови, изменяющие морфофункциональную полноценность эритроцитов, гемоглобина, ферментов плазмы (отрицательное влияние на эритроциты в процессе хранения);
- тромбозы, тромбофлебитическую болезнь; антикоагулянтную терапию.
Часть из перечисленных физиологических или патологических состояний (возраст до 10 лет, большие сроки беременности, бактериемия, сепсис, выраженное истощение, гемофилия, эпилепсия) выступают явными противопоказаниями для самой операции эндопротезирования крупных суставов. Наследственные заболевания крови среди подлежащих ортопедическим вмешательствам встречаются относительно редко и страдающие ими пациенты подлежат обязательной подготовке с участием гематологов, в ходе которой определяется допустимость заготовки аутокрови.
Из противопоказаний для предоперационной эксфузии чаще всего приходится учитывать пожилой и преклонный возраст, наличие сердечно-сосудистых заболеваний (ИБС, гипертоническая болезнь, транзиторные нарушения ритма) и исходно низкие показатели содержания гемоглобина и количества эритроцитов. Опубликованные результаты специально предпринятых исследований позволяют по-новому взглянуть на существо этих противопоказаний.
А.А. Elawad с соавторами обследовали 45 пожилых пациентов, средний возраст которых составил 71 (60 - 82) год и которые сдали 130 доз крови перед тотальным эндопротезированием тазобедренного сустава; 15 пациентов без эксфузии послужили контрольной группой. Осложнений при заготовке аутокрови не было; гематологические и биохимические показатели в периоде заготовки оставались в пределах нормальных величин. Заготовленная аутокровь обеспечила 97% процентов общих потребностей в переливании. В группе с аутогенной трансфузией наблюдали меньшую по сравнению с контролем послеоперационную и общую потерю крови; различия между группами по числу послеоперационных осложнений отсутствовали. Авторы сочли использование предварительно заготовленной аутогенной крови в плановой ортопедии, независимо от возраста пациентов, выполнимым, эффективным, экономичным и позволяющим исключить риск, связанный с гомологичным переливанием.
При удовлетворительном общем состоянии больного и нормальных показателях гемограммы возраст старше 70 лет не следует считать абсолютным противопоказанием к аутогемотрансфузии. Пациенты 70—80 лет прекрасно переносят эксфузии крови, и аутогемотрансфузии дают положительный эффект. Частота нежелательных реакций при аутогемотрансфузиях в пожилом возрасте даже уменьшается.
При исследовании клеточного состава крови и распределения клеток костного мозга по стадиям клеточного цикла было установлено, что основные показатели гемограммы у мужчин и женщин после 60 лет практически не отличаются от таковых у лиц молодого возраста. Выявлена лишь тенденция к уменьшению содержания тромбоцитов (Р > 0,05). Таким образом, отсутствие у пожилых людей существенных нарушений кроветворения авторы считают подтверждением возможности пересмотра возрастных ограничений для донорства крови.
С.А. Матвеев с соавторами, проанализировав результаты аутодонорства крови и её компонентов у 305 кардиохирургических больных (37 пациентов с врожденными, 161 - с приобретенными пороками и 107 - с ишемической болезнью сердца), установили, что при отсутствии противопоказаний однократные эксфузии крови в дозе 400 - 500 мл, плазмы в объеме 600 - 1500 мл, тромбоцитов - 150 - 290 млрд. клеток не вызывали существенного ухудшения состояния больных. Отмеченные функциональные сдвиги носили адаптационный характер, были кратковременны и не требовали специального лечения.
Противопоказаниями к переливанию аутогенной крови служит нормоволемия с достаточным количеством циркулирующего гемоглобина, то есть отсутствие показаний к переливанию любых эритроцитосодержащих сред.
Недостатки и возможные осложнения аутогемотрансфузии. К недостаткам аутогемотрансфузии многие авторы относят высокий процент невостребованности заготовленной аутокрови. В нашей серии из 4784 наблюдений избежать этого полностью не удалось, но средняя частота подобных случаев (8,98%) была существенно меньше цифр, приводимых в литературе. Тем более, что в последние 5 лет отмечена отчетливая тенденция к её снижению.
Консервированная кровь отчетливо отличается от циркулирующей в организме, причем эти отличия нарастают по мере хранения крови.
Морфофизиологические изменения клеточных элементов сводятся к следующему. Эритроциты изменяют свою форму, частично теряют поверхностный электрокинетический потенциал, макроэргические фосфаты и способность деформироваться, что затрудняет их прохождение через малые капилляры и обусловливает образование микроагрегатов (10 - 160 мкм). Последние возникают уже на 30 - 40 секунде после начала забора крови, полностью сформировываются к 4 - 5 минуте, а нарастание их числа завершается к восьмым суткам хранения крови.
Агрегаты величиной до 30 - 40 мкм не задерживаются стандартными фильтрами инфузионных систем, что при просвете капиллярных сосудов менее 15-25 мкм становится одной из главных причин возникновения (или усугубления) микроциркуляторных расстройств после инфузий консервированной крови. Поступление микроагрегатов на естественный легочный фильтр создает условия для формирования «шокового» легкого в тех случаях, когда ретикулоэндотелиальная система не способна элиминировать их возросшее количество.
Тромбоциты консервированной крови теряют свои свойства в течение первого дня хранения, а гранулоциты через 24 - 48 часов.
Несмотря на то, что пластиковые контейнеры и современные консервирующие растворы гарантируют пригодность крови для переливания в течение 45 суток, её замещающие свойства в конце срока хранения при положительной температуре значительно снижаются.
Заготовленная аутокровь, наряду с полной совместимостью, обладает теми же недостатками, что и донорская: состав её меняется в процессе хранения - эритроциты утрачивают свою стойкость и способность к передаче кислорода тканям, нарастает содержание К+ в плазме, понижается рН.
Поэтапная заготовка путем повторных эксфузий значительных (до 2 литров) объемов аутокрови требует определенного времени, связана с повторными венопункциями, а для сохранения кислородотранспортной функции эритроцитов - использования специальных приемов - повторных эксфузий-трансфузий.
При поэтапном методе через 4 суток после первого взятия 300 - 400 мл крови заготавливали еще 200 мл. Спустя еще 4-5 суток на заключительном третьем этапе больному переливалась вся ранее взятая кровь, и заготавливалось 800 мл свежей аутокрови.
А.Ю. Пащук, А.В. Иванова на каждом этапе, начиная со второго, возвращали ранее заготовленную кровь и вновь эксфузировали объем на 250 мл больше перелитого.
При так называемом ступенчато-поэтапном методе объем каждой последующей эксфузии увеличивают, а ранее заготовленную аутокровь возвращают больному. Так как манипулируют большими объемами, обязателен контроль гемодинамики, содержания гемоглобина и показателя гематокрита.
Дополнительные возможности предоставляет метод криоконсервирования компонентов крови.
Замороженные эритроциты сохраняют свою морфофункциональную полноценность в течение многих лет.
L. DePalma с соавторами провели ретроспективный анализ использования замороженных аутогенных эритроцитов: для 41 пациента в двух больницах было заготовлено 104 дозы. Пятнадцати из них (37%) возвращены одна или более доз заготовленных эритроцитов. Двадцати двум больным аутогенные эритроциты были заготовлены перед плановой операцией; половине этих пациентов они перелиты частично или полностью. У 16 пациентов заготовка аутоэритроцитов произведена в связи с редкими подгруппами крови или наличием множественных антител и трем - по их личной просьбе. Только 4 из 19 (21%) пациентов, сдавших кровь без определенного плана использования, получили, в конечном счете, переливание размороженных эритроцитов. Авторы пришли к заключению, что возможность длительного хранения криоконсервированных аутогенных эритроцитов способна улучшать результаты плановых хирургических вмешательств у пациентов с повышенными требованиями к качеству переливаемых сред.
В.А. Аграненко выделил преимущества метода криоконсервирования. Он позволяет:
- заготавливать заблаговременно в необходимых объемах аутологичные эритроциты, концентраты тромбоцитов и плазму;
- сохранять компоненты крови функционально полноценными в течение длительных сроков (годами);
- производить эксфузии крови амбулаторно задолго до поступления в стационар;
- проводить трансфузии аутоэритроцитов аллоиммунизированным больным, отличающимся тяжелыми посттрансфузионными реакциями на переливание гомологичных эритроцитов;
- проводить тромбоцитотерапию больных, аллоиммунизированных и рефрактерных к трансфузиям концентрата тромбоцитов;
- проводить трансфузии свежезамороженной аутоплазмы при дефиците факторов свертывания.
Размороженные и отмытые эритроциты ареактогенны, лишены плазменных белков, лейкоцитов и тромбоцитов, поэтому их трансфузии особенно показаны реактивным, аллоиммунизированным больным.
Применение эритропоэтина. L.T. Goodnough считал, что развитие и внедрение в практику рекомбинантного человеческого эритропоэтина (Еро) привело к появлению новых потенциальных возможностей лечения первичных и хирургических анемий.
Роль терапии Еро в периоперационном периоде определена как обеспечение возможности заготовки больших количеств аутогенной крови и улучшение послеоперационного эритропоэза, что уменьшает потребности в переливании гомологичной крови. Клиническое применение эритропоэтина автор обозначил как наступление новой эры трансфузионной медицины с включением фармакологических препаратов в стратегию сбережения крови.
F.L. Thompson с соавторами использовали рекомбинантный человеческий эритропоэтин, чтобы облегчить сбор крови для аутогенного переливания в ходе планового тотального реэндопротезирования тазобедренного сустава пациенту с алкогольным циррозом печени и множественными антителами к эритроцитам. За 4 месяца до этого у него была отсроченная реакция на переливание несовместимой эритроцитарной массы при желудочно-кишечном кровотечении. Лечение эритропоэтином привело к быстрому и непрерывному увеличению индекса ретикулоцитов от исходного 1,6 % до максимального 8,6 %, что сопровождалось увеличением гематокрита от 32 % до 38,5 %, несмотря на изъятие семи единиц аутогенной крови в течение 45 дней. Трудности канюлирования вены и возможности банка крови, а не уровень гематокрита определяли частоту взятия крови. Авторы заключили, что эритропоэтин стимулировал эритропоэз у пациента с хронической анемией и облегчил сбор аутогенной крови для плановой операции.
C.J. Rutherford с соавторами провели исследование на добровольцах с сохраненными запасами железа с целью разработки кратковременного, практичного, но эффективного режима предоперационного использования рекомбинантного человеческого эритропоэтина (r-HuEPO) как альтернативы заготовке аутогенной крови и/или гомологичному переливанию. Кроме того, были исследованы изменения кинетики железа в течение ускоренного эритропоэза.
Все испытуемые получали r-HuEPO по одной из трех схем дозировки до общей дозы 1200 ед/кг r-HuEPO подкожно: 1 группа - 300 ед/кг в 1, 4, 7, и 10 дни; 2 группа - 400 ед/кг в 1, 5, и 9 дни; 3 - 600 ед/кг в 1 и 10 дни. Помимо этого, они принимали 300 mg элементного железа через рот ежедневно в течение 10 дней, начиная с первого дня. Развернутые анализы крови с подсчетом количества ретикулоцитов, определением ферритина, содержания железа, общей железосвязывающей способности и концентрации трансферрина сыворотки выполняли периодически в течение 24 дней.
Во всех группах отмечено статистически существенное увеличение гематокрита, гемоглобина и абсолютного индекса ретикулоцитов. Каждая из схем дозировки r-HuEPO обеспечивала эффективный, удобный режим для использования перед операцией. Однако «нормальные» для базисного эритропоэза запасы железа не всегда способны обеспечить оптимальные условия для ускоренного эритропоэза при быстром применении r-HuEPO даже с дополнительным введением железа перорально. Тем не менее, результаты свидетельствуют в поддержку использования r-HuEPO в качестве альтернативы заготовки аутогенной крови в периоперационном периоде.
I. Saikawa с соавторами обследовали больных ревматоидным артритом (12 пациентов с анемией и 10 - без анемии), леченных перед эндопротезированием рекомбинантным человеческим эритропоэтином (r-HuEPO) в дозе 400 - 800 ед/кг подкожно один раз в неделю. Аутогенную кровь заготавливали после того, как концентрация гемоглобина увеличивалась на 5 или больше процентов. Все, кроме одного из пациентов, положительно реагировали на лечение, сдали по 1 - 3 дозы аутогенной крови и перенесли операцию без гомологичной трансфузии. Средняя продолжительность лечения составила 1 месяц. У пациента с тяжелой анемией потребовалось дополнительное переливание донорской крови в течение операции. Полученные результаты свидетельствовали, что лечение подкожным введением r-HuEPO эффективно, нетоксично и может исключить необходимость переливания гомологичной крови у анемичных пациентов при эндопротезировании по поводу ревматоидного артрита (РА).
Рекомбинантный человеческий эритропоэтин может сыграть существенную роль при плановых операциях со значительной потерей крови, включая сложные ревизионные и двусторонние тотальные эндопротезирования суставов. Дооперационное применение эритропоэтина (Epoetin alfa) увеличивает возможность дооперационной заготовки аутогенной крови и периоперационную массу эритроцитов.
Применение отечественного эритропоэтина ("Эпокрин" ГНЦ ГосНИИ особо чистых биопрепаратов) у больных с дегенеративно-дистрофическими поражениями тазобедренного и коленного суставов и РА в дозе 30 - 60 - 100 ед/кг каждые 3 дня с одновременным ежедневным приемом Ферро-градумета закономерно приводило к увеличению числа Эр и содержания Hb на 20 ± 3 г/л. Применение максимальной из указанных доз позволило в течение 2 недель достигнуть нижней границы нормальных величин у пациентов с РА при подготовке к эндопротезированию.
Фракционирование аутогенной крови
Компонентный принцип трансфузионной терапии вполне применим к аутогенным переливаниям. Фракционирование заготовленной аутокрови с получением аутогенной эритроцитарной массы (аутоЭМ) и свежезамороженной аутоплазмы (аутоСЗП) существенно усиливает терапевтический эффект их использования при восполнении операционной кровопотери. Вопросы наиболее рационального использования каждого из компонентов требуют дальнейшего направленного изучения.
Наличие в кабинете или отделении переливания крови рефрижераторной центрифуги, низкотемпературного холодильника позволяет путем повторных сеансов плазмафереза получить 500 - 800 мл аутоСЗП. Хранение при низких температурных режимах существенно уменьшает вероятность потерь аутоСЗП (до 2%), одновременно повышая лечебный эффект аутогенных переливаний.
С 1999 г. значительная часть аутогенной крови в первые часы после изъятия была подвергнута нами гравитационному разделению на аутоэритроцитную массу и аутоплазму, которая незамедлительно замораживалась. В 2006 г. фракционировано 90% заготовленной аутокрови.
При повторных эксфузиях ранее заготовленные дозы аутоЭМ могут быть возвращены больному.
P.M. Тихилов с соавторами при прогнозируемой значительной (более 1,5л) интраоперационной кровопотере для заготовки компонентов аутокрови использовали разработанный ими метод «эксфузии-селективной аутогемотрансфузии», позволяющий запасти к моменту операции необходимое количество аутоСЗП и аутоЭМ малых (до 5 сут) сроков хранения.
На I этапе (за 8-10 дней до оперативного вмешательства) производили эксфузию 1 дозы аутологичной крови в полимерный контейнер типа «Гемакон» 500/300». Кровь незамедлительно фракционировали на аутоЭМ и аутоСЗП. Через 3-4 дня (т.е. за 4 - 5 дней до операции), на II этапе производили эксфузию второй дозы аутокрови, которую также фракционировали. Затем аутодонору производили переливание заготовленной ранее аутоЭМ, ресуспензированной в изотоническом 0,9% растворе натрия хлорида в соотношении 1:1. По окончании аутоэритроцитотрансфузии у больного эксфузировали еще одну дозу крови (№ 3), которую фракционировали аналогично первым двум дозам. В результате двухэтапного резервирования аутогемокомпонентов (АГК) перед операцией удавалось накопить 2 дозы аутоЭМ малых сроков хранения и 3 дозы аутоСЗП (в объеме 750 - 960 мл). Весь подготовительный цикл занимал 8-10 дней, к моменту операции имелось 2 дозы аутогенной эритроцитной массы малых сроков хранения и 750 - 1020 мл аутоСЗП.
Если предполагали, что такого количества аутогемокомпонентов было недостаточно для восполнения интраоперационной кровопотери, то резервирование проводили в 3 этапа. Дооперационную заготовку АГК начинали на 3 - 4 дня раньше (за 12 -14 дней до планируемой операции), а на третьем этапе эксфузировали 3 дозы аутокрови с одновременной трансфузией 2 доз аутоЭМ. В результате до операции удавалось накопить 3 дозы аутоЭМ малых сроков хранения и 1250- 1800 мл аутоСЗП. При проведении «эксфузии-селективной аутогемотрансфузии» восполнения объема эксфузированной крови кровезамещающими растворами не требовалось.
Наблюдение за состоянием больного, изучение его клинико-лабораторных показателей после каждого этапа метода «эксфузии-селективной аутогемотрансфузии» позволяло определить возможные объемы резервирования аутогенных гемокомпонентов.
Основными ориентирами для принятия решения о возможности проведения дальнейших этапов метода «эксфузии-селективной аутогемотрансфузии» являлись: клиническое состояние больного, гематокритное число, количество эритроцитов, содержание гемоглобина, количество тромбоцитов, общего белка в периферической крови аутодонора. Снижение этих показателей более чем на 10% в течение одного этапа операции свидетельствовало об ограничении компенсаторных физиологических резервов организма аутодонора и являлось основанием для отказа от продолжения гемоэксфузий.
Заготовка в отделении (или кабинете) переливания крови лечебного учреждения свежезамороженной аутоплазмы методом плазмофереза позволяет накопить её в необходимых количествах и использовать как при возмещении внутрисосудистого объема, так и для восполнения дефицита плазменных факторов свертывания.
Наличие 1 - 3 доз аутогенной СЗП предоставляет дополнительные возможности коррекции остро возникающих нарушений коагуляции при массивной интраоперационной кровопотере и/или интраоперационном возврате эритроцитов аппаратами Cell Saver.
Вопросы тактики использования свежезамороженной плазмы, в том числе и аутогенной, для восполнения кровопотери при эндопротезировании крупных суставов требуют дальнейшей разработки и обоснования.
Р.М. Тихилов, В.М. Шаповалов
РНИИТО им. Р.Р. Вредена, СПб
Подберём Вам бесплатно нужного врача-специалиста

